

| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
 Mn2++Cl2↑+2H2O (2分,其它合理的也对)
Mn2++Cl2↑+2H2O (2分,其它合理的也对)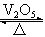 2SO3 (2分) ②5Cl2+I2+6H2O=2HIO3+10HCl (2分)
2SO3 (2分) ②5Cl2+I2+6H2O=2HIO3+10HCl (2分)

科目:高中化学 来源:不详 题型:实验题


| A.磷铵样品与氢氧化钠未充分反应 | B.A和B中残留了一定量的氨气 |
| C.氢氧化钠溶液的浓度太大 | D.鼓气过快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.上下移动①中铜丝可控制SO2的量 |
| B.②中品红溶液不褪色 |
| C.③中石蕊溶液变蓝色 |
| D.为确认CuSO4生成,向①中加水,观察溶液颜色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.试管中盛酚酞试液,验证氨气的水溶液呈碱性 |
| B.试管中盛酸性高锰酸钾溶液,探究SO2的还原性 |
| C.试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 |
| D.试管中盛淀粉KI溶液,验证氯气氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可以利用烧碱溶液除去混在MgO中的Al2O3 |
| B.用四氯化碳萃取碘水中的碘单质,上层显紫红色 |
| C.将Fe(OH)3沉淀溶于沸水可制得Fe(OH)3胶体 |
| D.测定Na2CO3溶液的pH值,操作时应将先pH试纸润湿 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com