
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
分析 ①原子序数为15的元素P,同主族自上而下原子半径增大;
②同周期中,从左向右非金属性增强;
③第二周期第ⅣA族元素为碳,非金属性越强,氢化物越稳定;
④原子序数为12的元素为Mg,金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:①原子序数为15的元素为P,N、P同主族,自上而下原子半径增大,故P元素原子半径较大,故错误;
②同周期中,从左向右非金属性增强,则第ⅦA族元素是同周期中非金属性最强的元素,故正确;
③第二周期第ⅣA族元素为碳,同周期随原子序数增大,非金属性减弱,氢化物稳定性增强,故氨气的稳定性较强,故错误;
④原子序数为12的元素为Mg,同周期随原子序数增大,金属性减弱,最高价氧化物对应水化物的碱性减弱,故氢氧化镁的碱性强于氢氧化铝,故正确,
故选C.
点评 本题考查原子结构与元素周期律,难度不大,注意对元素周期律的理解掌握,有利于基础知识的巩固.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
| 要提纯的物质 (杂质) | 乙醇 (水) | 乙炔(H2S) | 溴苯 (溴) |
| 选用试剂 | |||
| 分离方法 | 1 |
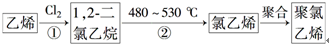
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A=HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
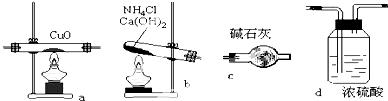 实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.
实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com