
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是

A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =4.2,则Ka2(H2A)的数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
【答案】B
【解析】A. M点溶液体积大于20mL,2c(HA-)+c(A2-)<0.2 mol/L,故A错误;B. 溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),N点溶液呈酸性,c(H+)>c(OH-),c(HA-)=c(A2-),则c(Na+) < 3c(HA-),故B正确;C. 若N点溶液pH =4.2,c(H+)=10-4.2mol/L,c(HA-)+2c(A2-),则Ka2(H2A)= 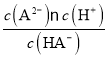 =c(H+)=10-4.2=10-(5-0.8),数量级为105,故C错误;D. N点溶液pH =4.2,所以V(NaOH)=20mL时的溶液中:c(H+) > c(OH-),故D错误。故选B。
=c(H+)=10-4.2=10-(5-0.8),数量级为105,故C错误;D. N点溶液pH =4.2,所以V(NaOH)=20mL时的溶液中:c(H+) > c(OH-),故D错误。故选B。


科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G(![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
![]()
已知以下信息:
① 。
。
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)C的化学名称为___________________。
(2)B和C反应生成D的化学方程式为_________________________________。
(3)B中含氧官能团的名称为__________________。
(4)E和F反应生成G的化学方程式为_______________,反应类型为________。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有_________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用红外光谱对有机化合物分子进行测试并记录,可初步判断该有机物分子拥有的
A. 同分异构体数 B. 原子个数 C. 基团种类 D. 共价键种类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在周期表中的相对位置如图所示,其中Q原子的质子数是其最外层电子数的三倍。下列说法正确的是

A. 原子半径:R>T
B. 氧化物对应水化物的酸性:W>Q
C. 最简单气态氢化物的热稳定性:R>Q
D. Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如下图。下列说法正确的是

A. Fe(II)为阳极
B. M电极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O
C. 电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出
D. 电路中每转移6mol电子,最多有1 mol Cr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与Na2CO3溶液混合时产生蓝绿色沉淀,某实验小组进行实验,探究蓝绿色沉淀的组成。
【查阅资料】
i.氢氧化铜是一种蓝色絮状沉淀,难溶于水,溶于酸、氨水等,受热会分解。
ii.碳酸铜是蓝绿色粉末状固体,受热易分解,遇水转化为氢氧化铜和碱式碳酸铜的混合物。
iii.碱式碳酸铜呈孔雀绿颜色,又叫孔雀石,难溶于水,溶于酸、氨水等,在空气中加热会分解。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为xCuCO3yCu(OH)2]
(1)假设1中产生沉淀Cu(OH)2的离子方程式是_______。
(2)甲同学认为假设2不成立,理由是_______。
【定性实验】
(3)实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到_______,证明假设3成立。
【定量实验】
为了确定碱式碳酸铜化学式中x与y的关系,实验小组称取净化后的蓝绿色固体m1 g,使用下列装置(夹持仪器未画出)进行实验。
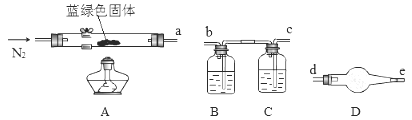
(4)B、C、D中的试剂依次为_______(填标号)。
a.澄清石灰水 b.碱石灰 c.氯化钙溶液 d.浓硫酸
(5)各装置接口的连接顺序:a→_______(填字母序号)。
(6)装置D的作用是_______。
(7)加热到固体完全分解,硬质玻璃管中得到黑色固体,其余产物被相应装置完全吸收。实验结束后,测得装置B的质量增加m2 g,则xCuCO3yCu(OH)2中![]() =_______(列式表示)。若无D装置,则
=_______(列式表示)。若无D装置,则![]() 的值_______(填“偏大”或“偏小”或“无影响”)。
的值_______(填“偏大”或“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)大小烧杯间填满碎泡沫塑料的作用___________。
(2)___________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒。其原因是_________________。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_________(填“偏高”或“偏低”或“无影响”)。
(4)如果改用60mL 1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量__________(“增加”、“减少”或“不变”),理由是______________;所求中和热数值_______(“增加”、“减少”或“不变”),理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
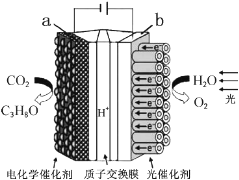
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com