
分析 (1)依据盐类水解分析判断,Na2S2O3为强碱弱酸盐;
(2)碘单质遇淀粉显蓝色,当碘单质消耗,蓝色褪去;
(3)根据反应找出反应关系式,然后根据题中数据计算出加碘食盐样品中的碘元素含量;
(4)若滴定前平视KMnO4溶液液面,滴定后俯视液面刻度,读取标准溶液体积减小;
解答 解:(1)Na2S2O3为强碱弱酸盐,因为硫代硫酸根离子水解,Na2S2O3溶液呈弱碱性,所以滴定时Na2S2O3溶液应放在碱性滴定管中,
故答案为:碱式滴定管;
(2)b中生成I2,c中使用淀粉作为指示剂,加入淀粉,溶液呈蓝色,用Na2S2O3溶液滴定,I2反应完毕,溶液蓝色褪色,滴定终点现象为:蓝色变无色,且保持半分钟不变色,
故答案为:蓝色变无色,且保持半分钟不变色;
(3)20mL溶液消耗Na2S2O3的物质的量为1.00×10-3mol/L×0.02L=2.00×10-5mol,根据IO3-+5I-+6H+=3I2+3H2O,I2+2S2O32-=2I-+S4O62-,则:
IO3-~3I2~6S2O32-,
1 6
xmol 2.00×10-5mol
所以x=$\frac{2.00×1{0}^{-5}mol}{6}$
故加碘食盐样品中的碘元素的质量是$\frac{2.00×1{0}^{-5}mol}{6}$×127g/mol×103mg/g=$\frac{127×1{0}^{-2}}{3}$mg,所以加碘食盐样品中的碘元素含量为$\frac{\frac{127×1{0}^{-2}}{3}mg}{W×1{0}^{-3}Kg}$=$\frac{1270}{3W}$mg/kg,
故答案为:$\frac{1270}{3W}$;
(4)若滴定前平视KMnO4溶液液面,滴定后俯视液面刻度,读取标准溶液体积减小,c(待测)=$\frac{c(标准)c(标准)}{c(待测)}$,分析可知测定结果偏小,
故答案为:小;
点评 本题考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量,为易错点,题目难度中等.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L 0.1 mol•L-1的AlCl3溶液 | B. | 1 L 0.1 mol•L-1的FeCl2溶液 | ||
| C. | 1 L 1 mol•L-1的NaCl溶液 | D. | 1 L 2 mol•L-1的KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
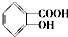 .
.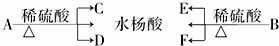
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | 水分解成氢气和氧气吸收热量 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com