
分析 NaHSO3的水解常数为Kh=$\frac{c({H}_{2}S{O}_{3})×c(O{H}^{-})}{c(HS{{O}_{3}}^{-})}$=$\frac{{K}_{w}}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1.54×1{0}^{-2}}$=6.49×10-7,根据kh与Ka2的相对大小分析.
解答 解:NaHSO3的水解常数为Kh=$\frac{c({H}_{2}S{O}_{3})×c(O{H}^{-})}{c(HS{{O}_{3}}^{-})}$=$\frac{{K}_{w}}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1.54×1{0}^{-2}}$=6.49×10-7,NaHSO3的水解显碱性,NaHSO3电离显酸性,由于水解常数小于电离常数(Ka2),所以NaHSO3在溶液中以电离为主,即溶液显酸性;
答:NaHSO3水溶液显酸性.
点评 本题考查了盐的水解常数和电离常数的应用,题目难度中等,侧重于考查学生的分析能力和计算能力,注意根据电离常数与水解常数的相对大小判断溶液的酸碱性.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| HClO4 | H2SO4 | HCl | HNO3 | |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中高氯酸是这四种酸中最强的酸 | |
| B. | 在冰醋酸中硫酸的电离方程式为H2SO4═2H++SO42- | |
| C. | 在冰醋酸中这四种酸都没有完全电离 | |
| D. | 酸的强弱与其本身的结构和溶剂的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
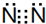 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定含有Br-、SO42- | |
| B. | 原溶液一定含有Na+,不含Ba2+ | |
| C. | 实验①与上述离子的检验无关,可以省略 | |
| D. | 若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液、氯水 | B. | 稀盐酸、KMnO4溶液 | ||
| C. | 稀硫酸、KMnO4溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com