
| A、向100mL0.12mol/L的Ba(OH)2溶液中通入0.02mol CO2:OH-+CO2→HCO3- |
| B、向Ca(OH)2溶液中加入过量的 NaHCO3溶液:Ca2++2OH-+2HCO3-→CaCO3↓+CO32-+2H2O |
| C、向0.2mol溴化亚铁溶液中通入0.2mol氯气:2Fe2++4Br-+3Cl2→2Fe3++6Cl-+2Br2 |
| D、硫酸氢钠与氢氧化钡两种溶液反应后恰好为中性:H++SO42-+Ba2++OH-→BaSO4↓+H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.36g水中所含中子数一定为0.2NA |
| B、4.48L N2与CO的混合物所含分子数一定为0.2NA |
| C、6.4gS6与S8的混合物中所含S原子数一定为0.2NA |
| D、标准状况下,2.24 L氧气所含原子数一定为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) |
K1=4.30×l0-7 | K1=1.54×l0-2 | K=2.95×l0-8 |
| K2=5.61×l0-11 | K2=1.02×l0-7 |
| A、ClO-+CO2+H2O→HClO+HCO3- |
| B、SO32-+CO2+H2O→HSO3-+HCO3- |
| C、2ClO-+SO2+H2O→2HClO+SO32- |
| D、2HSO3-+CO32-→2SO32-+CO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
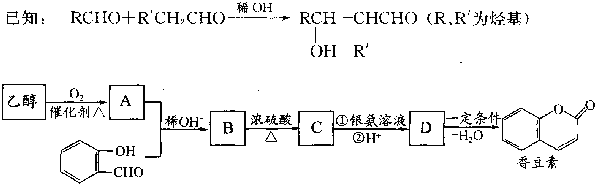
 有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式是
有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
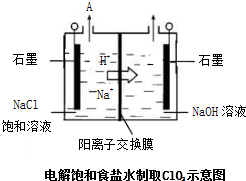
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com