
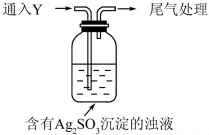
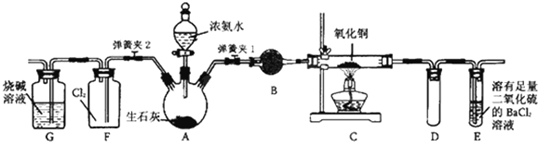
 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
分析 (1)Na2SO3为强碱弱酸盐,在溶液中水解显碱性,AgNO3为强酸弱碱盐,在溶液中水解显酸性;
(2)②Ag2O为碱性氧化物和酸反应生成盐和水;
(3)亚硫酸根离子具有还原性,氧气具有氧化性,Na2SO3与AgNO3以及空气中的氧气反应生成硫酸银;设计实验确认白色沉淀是否为Ag2SO4,根据Ag2SO3白色,难溶于水,溶于过量Na2SO3的溶液分析,设计对照试验;
(4)①亚硫酸银能分解生成氧化银,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,因氧化银和盐酸生成白色氯化银沉淀和水;②向X中加入过量浓HNO3,产生红棕色气体为NO2,说明为银和硝酸的反应,分析X是银;③银和硝酸反应生成硝酸银、二氧化氮、水;
(5)①溶液的酸性增强,+4价硫的还原性增强,能被+1价银氧化,+4价硫的氧化物为二氧化硫;
②酸性增强.+4价硫的亚硫酸银,被+1价银氧化生成银和硫酸.
解答 解:(1)Na2SO3为强碱弱酸盐,在溶液中水解显碱性,则溶液的pH=10,其水解离子方程为:SO32-+H2O?HSO3-+OH-,AgNO3为强酸弱碱盐,在溶液中pH=5,其水解离子方程为:Ag++H2O?H++AgOH,
故答案为:SO32-、Ag+;
(2)②Ag2O为碱性氧化物,和盐酸反应生成氯化银和水,反应为:Ag2O+2HCl=2AgCl+H2O,故答案为:Ag2O+2HCl=2AgCl+H2O;
(3)亚硫酸根离子具有还原性,氧气具有氧化性,溶液的pH=10,Na2SO3被氧气氧化,Na2SO3与AgNO3以及空气中的氧气反应:2Ag++O2+2SO32-=Ag2SO4↓+SO42-,
Ag2SO3白色,难溶于水,溶于过量Na2SO3的溶液,取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解,说明B、C中白色沉淀为Ag2SO3,另取Ag2SO4固体,同样条件置于足量Na2SO3溶液中,进行对照试验,发现沉淀不溶解,
故答案为:2Ag++O2+2SO32-=Ag2SO4↓+SO42-;Na2SO3;
(4)①氧化银能和盐酸生成白色氯化银沉淀和水,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,
故答案为:Ag2O;
②向X中加入过量浓HNO3,产生红棕色气体为NO2,X与浓硝酸发生氧化还原反应,X只能为金属单质,只能为银,故答案为:Ag;
③向X中加入过量浓HNO3,产生红棕色气体为NO2,银和硝酸反应,氮元素从+5变为+4价,同时生成硝酸银和水,反应为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O,
故答案为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O;
(5)①海绵状棕黑色物质X为Ag,产生Ag的原因,可能为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化,实验确认,可通+4价硫的氧化物二氧化硫进行实验确认,通入二氧化硫后,瓶中白色沉淀Ag2SO3转化为棕黑色Ag,
故答案为:SO2;
②X为Ag,白色沉淀转化为X,为在酸性条件下,亚硫酸银中+4价的硫,被+1价银氧化生成银和硫酸,反应为:Ag2SO3+H2O$\stackrel{H+}{→}$2Ag+H2SO4,
故答案为:Ag2SO3+H2O$\stackrel{H+}{→}$2Ag+H2SO4.
点评 本题考查了盐的水解原理的应用、氧化还原反应等知识,侧重于学生的分析能力的考查,掌握硫、氮及其化合物的性质是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 等质量的氢气完全燃烧分别生成气态水和液态水,前者△H大于后者 | |
| B. | 破坏反应物全部化学键所需要的能量小于破坏生成物全部化学键所需要的能量时,该反应为吸热反应 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,可知含1molH2SO4的浓硫酸与含1molNaOH的烧碱溶液混合,放出热量等于57.3kJ | |
| D. | H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
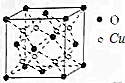 科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.
科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.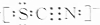 ,则SCN-中σ 键与π键的个数比为1:1.
,则SCN-中σ 键与π键的个数比为1:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,则水热反应可以降低自然界中碳的含量 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,则PM2.5在空气中有可能形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
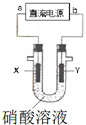 某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )
某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )| A. | a极为负极,b极为正极 | |
| B. | 电解时,Y极附近溶液pH降低 | |
| C. | 相同条件下,阴阳两极气体体积比是2:1 | |
| D. | X极的电极反应式是:2H++NO3-+e-═NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素水解的最终产物都是葡萄糖 | |
| B. | 误服可溶性重金属盐,立即服用大量牛奶可以解毒 | |
| C. | 用灼烧的方法可鉴别毛织物和棉织物 | |
| D. | 温度越高,酶对某些化学反应的催化效率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com