
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____;B______。
2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____;B______。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H>0,该设想能否实现?____(选填“能”或“不能”),依据是____。
(2)一定条件下,Fe3+和I﹣在水溶液中的反应是2I﹣+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____。
(3)已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-ckJ·mol-1
则下列叙述正确的是______
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ·mol-1
C.2CH3OH(g)=2CH4(g)+O2(g) ΔH=2(b-a)kJ·mol-1
D.若甲醇和甲烷的物质的量之比为1∶2,其完全燃烧生成CO2和H2O(l)时放出的热量为QkJ,则该混合物中甲醇的物质的量为![]() mol
mol
【答案】温度升高,反应速率加快 温度升高,有利于平衡反应正向进行 不能 该反应是焓增、熵减的反应,任何温度下均不能自发进行 正反应 加入少许铁粉或加入少许碘 C
【解析】
(1)①N2(g)+O2(g)=2NO(g)△H>0,反应是气体体积不变的吸热反应,温度升高,反应速率加快,平衡右移,单位时间内NO排放量越大;
②2CO(g)=2C(s)+O2(g)△H>0,反应是焓变增大,熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;
(2)加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向正反应方向移动;增大生成物浓度或减小反应物浓度平衡逆向移动,加入少许铁粉可以与三价铁离子反应,减小反应物浓度,加入少许碘,增大生成物的浓度,平衡均逆向移动。
(3)A. 气态水到液态水继续放热,所以b<c,故A错误;
B. 燃烧热应生成稳定氧化物,不能是水蒸气,应该是液态水,故B错误;
C. 根据盖斯定律,2×(①-②)得到:2CH3OH(g)=2CH4(g)+O2(g)△H=2(b-a)kJ·mol1,故C正确;
D. 设甲醇和甲烷物质的量分别为n、2n,则甲醇放出的热量是na,甲烷放出的热量是2nc,即na+2nc=Q,解得n=![]() mol,则该混合物中甲醇的物质的量为
mol,则该混合物中甲醇的物质的量为![]() ,故D错误。
,故D错误。
答案选C。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】将5g某金属加入到100mL 2mol L-1的硫酸溶液中,当硫酸浓度降低到原浓度的一半时(设溶液体积不变),金属还没有全部溶解。该金属可能是
A.AlB.ZnC.FeD.Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1) SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l)。已知室温下2 g SiH4自燃放出的热量为89.2 kJ,则其热化学方程式为: _____________________。
(2)沼气是一种能源,它的主要成分是CH4,其燃烧的热化学方程式为:CH4(g)+2O2(g) = CO2(g)+2H2O(l ) ΔH=-890 kJ/mol,又已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则11.2 L(标准状况)CH4完全燃烧生成气态水时放出的热量为_______________。
Ⅱ.已知下列几种烷烃的燃烧热如下:
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
燃烧热/ (kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10 L(标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480 kJ。
(1)试写出乙烷气体燃烧的热化学方程式___________________________________。
(2)计算该天然气中甲烷的体积分数____________(保留小数点后两位)。
(3)由上表可总结出的近似规律是______________________________________________。
(4)根据(3)的近似规律可预测癸烷的燃烧热约为______kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
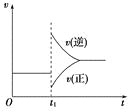
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验小组,为验证氯单质的氧化性强于硫和氮气,设计了一套实验装置:(部分夹持装置已略去)
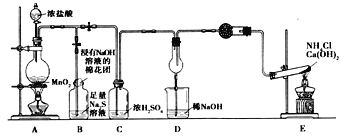
(1)写出A中反应的离子方程式_________。
(2)实验中证明氧化性Cl2>S的实验现象为___________。
(3)D干燥管中产生大量白烟,该反应的化学方程式为 ____________________。
(4)有同学认为从C排出的Cl2可能含有某杂质气体,影响D中现象的判断,该杂质气体是__________,若除去该杂质气体可以用___________溶液。
(5)E装置中反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德常数为NA,则下列说法正确的是( )
A.常温常压下,11.2LCH4中含有的氢原子数为2NA
B.标准状况下,22.4 L二氧化硫中含有氧原子数为NA
C.2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.1L0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol/L的Na2CO3溶液250mL稀释到1000mL,
(1)求稀释后溶液中溶质Na2CO3的质量。___
(2)求稀释后溶液中Na2CO3的物质的量浓度。___
(3)将稀释后的1000mL溶液取出400mL,求余下溶液中Na+的物质的量浓度。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物X的结构如图所示,下列叙述不正确的是( )
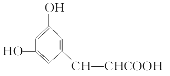
A. X分子中最多可有9个碳原子共平面
B. X可以发生取代、加成、聚合等反应
C. 1molX与足量NaHCO3溶液反应所得物质的分子式为C9H7O4Na
D. 苯环上的取代基与X完全相同的X的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com