
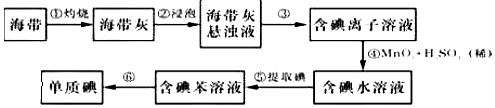
分析 海带灼烧后得到海带灰浸泡后得到海带灰的浊液,过滤得到含碘离子的溶液加入二氧化锰和稀硫酸氧化碘离子为碘单质,得到含碘水溶液,加入有机溶剂苯,萃取分液得到含碘的苯溶液,通过蒸馏得到碘单质,
(1)根据灼烧海带需要加热装置进行分析;
(2)分离固体和液体用过滤,分离互溶的两种液体用蒸馏;
(3)萃取剂的选取标准:溶质和萃取剂不反应、萃取剂和原溶剂不互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;萃取的主要仪器是分液漏斗.
(4)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰.
解答 解:(1)灼烧海带需要加热装置,所以步骤①灼烧海带时,除需要三脚架,坩埚,泥三角外,还需要用到的实验仪器是酒精灯,故选:BDE,
故答案为:BDE;
(2)步骤③是分离固体和液体,则实验操作为过滤,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,
步骤⑥是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏,
故答案为:过滤;蒸馏;
(3)苯和水不互溶,碘在苯中的溶解度大于在水中的溶解度,且碘和苯不反应,所以苯可以作萃取剂,还可以选用四氯化碳,萃取所使用的主要玻璃仪器是分液漏斗,
故答案为:苯和水不互溶,碘在苯中的溶解度大于在水中的溶解度,碘和苯不反应;
(4)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰.即先加盐酸酸化,无现象,再加氯化钡溶液,出现白色沉淀,说明含有SO42-,
故答案为:加盐酸酸化,无现象,再加氯化钡溶液,出现白色沉淀,说明含有SO42-.
点评 本题考查海水资源的综合利用,侧重考查物质的检验、混合物的分离和提纯,明确常见混合物分离和提纯方法及其选取方法是解本题关键,常见的分离方法有:过滤、蒸馏、渗析、加热等,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气是绿色气体,不会污染空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol | B. | 0.06mol | C. | 0.12mol | D. | 0.24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
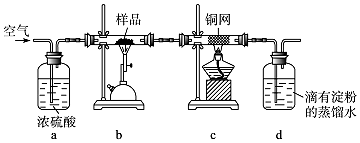
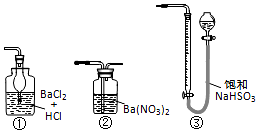
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
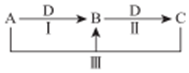 A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNacl 固体中含有NA个Na+ | |
| B. | 18gD2O和18gH2 O中含有的质子数均为10NA | |
| C. | 标准状况下2.24LH2O 含有的共价键数为0.2NA | |
| D. | 密闭容答中2molNO 与lmolO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性强弱为:X>Y>Z | |
| B. | 气态氢化物的稳定性由强到弱为X、Y、Z | |
| C. | 原子半径大小是:X<Y<Z | |
| D. | 对应阴离子的还原性按X、Y、Z顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②⑤⑥ | C. | ③⑤⑥④ | D. | ①③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com