
| m |
| M |
| n |
| V |
| 2.33g |
| 233g/mol |
| 9.85g |
| 197g/mol |
| 0.05mol |
| 0.05L |
| 0.01mol |
| 0.05L |


科目:高中化学 来源: 题型:
| A、手性异构体性质相同 |
| B、互为手性异构体的分子互为镜像 |
| C、手性异构体分子组成相同 |
| D、手性催化剂只催化或主要催化一种手性分子的合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氧的质量是16g?mol-1 |
| B、Na+的摩尔质量是23g?mol-1 |
| C、CO2的摩尔质量是44g |
| D、氢的摩尔质量是2g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
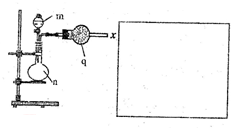 该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.
该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.查看答案和解析>>
科目:高中化学 来源: 题型:
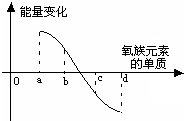 元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含Po)的部分知识如下表所示,
元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含Po)的部分知识如下表所示,| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com