
【题目】(1)NaF 的水溶液呈__(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____,溶液中含有的各离子浓度从大到小的顺序为______。
(2)AlCl3 水溶液呈__(填“酸”、“中”、“碱”)性,把 AlCl3 溶液蒸干,灼烧,最后得到的主要固体产物是 ______。
(3)CaCl2 溶液与 Na2CO3 溶液混合可形成 CaCO3 沉淀,现将 4×10-4mol/L Na2CO3 溶液与某浓度的 CaCl2溶液等体积混合,则生成沉淀所需 CaCl2 溶液的最小浓度为__ mol·L-1(已知:KSP(CaCO3)=2.8×10-9)
【答案】 碱性 F-+H2O![]() HF+OH- c(Na+)> c(F-) > c(OH-) >c(H+) 酸性 Al2O3 2.8×10-5
HF+OH- c(Na+)> c(F-) > c(OH-) >c(H+) 酸性 Al2O3 2.8×10-5
【解析】(1)NaF是强碱弱酸盐,F-水解,溶液呈碱性,原因是:F-+H2O![]() HF+OH-,F-水解浓度减小,而水解是微弱的,溶液中含有的各离子浓度从大到小的顺序为c(Na+)> c(F-) > c(OH-) >c(H+);(2)AlCl3为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O
HF+OH-,F-水解浓度减小,而水解是微弱的,溶液中含有的各离子浓度从大到小的顺序为c(Na+)> c(F-) > c(OH-) >c(H+);(2)AlCl3为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O![]() Al(OH)3+3H+,水解后溶液呈酸性,加热时促进水解,生成Al(OH)3,Al(OH)3不稳定,灼烧时分解生成Al2O3;(3)等体积混合后,碳酸钠的浓度变2×10-4mol/L。根据溶度积常数的概念可知,生成沉淀所需CaCl2溶液的最小浓度为
Al(OH)3+3H+,水解后溶液呈酸性,加热时促进水解,生成Al(OH)3,Al(OH)3不稳定,灼烧时分解生成Al2O3;(3)等体积混合后,碳酸钠的浓度变2×10-4mol/L。根据溶度积常数的概念可知,生成沉淀所需CaCl2溶液的最小浓度为![]() =1.4×10-5mol/L,所以混合之前的浓度为2.8×10-5 mol/L。
=1.4×10-5mol/L,所以混合之前的浓度为2.8×10-5 mol/L。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中发生反应:H2(g)+CO(g) ![]() C(s)+H2O(g).初始时加入平均相对分子质量为 15 的 H2、CO 混合气体,反应一段时间后测得气体的平均相对分子质量为 16,下列说法正确的( )
C(s)+H2O(g).初始时加入平均相对分子质量为 15 的 H2、CO 混合气体,反应一段时间后测得气体的平均相对分子质量为 16,下列说法正确的( )
A. 反应前后气体的压强之比为 2:1
B. 此时 CO 的转化率为 50%
C. 反应前后气体的密度之比为 15:14
D. 如果反应继续向正向进行,气体的平均相对分子质量将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用烃A合成高分子化合物N的流程如图:
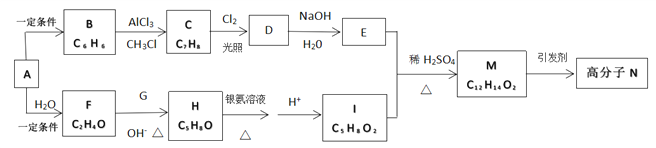
经测定烃A在标准状况下的密度为1.16 g.L-1,F和G是同系物,核磁共振氢谱显示有机物H中有四种峰,且峰值比为3:3:1:1。已知:
Ⅰ.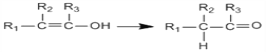 Ⅱ.
Ⅱ.![]()
Ⅲ.![]() (R1、R2、R3代表烃基或氢原子)回答下列问题:
(R1、R2、R3代表烃基或氢原子)回答下列问题:
(1)写出A的结构简式_________________。
(2)H中所含官能团的名称是_______________________。
(3)写出F和G反应生成H的化学方程式______________________________________。
(4)M→N的反应类型是________________;写出H与银氨溶液反应的化学方程式_____________________________________。
(5)E和I反应生成M的化学方程式为________________________________________。
(6)芳香族化合物Q是M的同分异构体,与M具有相同官能团,且水解可以生成2-丙醇,则Q的种类有_________________________种。(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
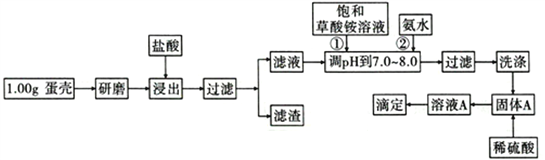
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________________________________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________________。
(3)洗涤最好选用_____(填“冰水”或“0. lmol/L草酸铵溶液”),其目的是____________________。
(4)在一定温度下,向2L的密闭容器中放入足量的草酸钙(固体所占体积忽略不计)发生反应: CaC204(s) ![]() CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
(5)滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。 步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消粍KMnO4溶液V1mL。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol /L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2= 20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4 = 20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为____________________。
②滴定终点的现象是________________________________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_________实际值(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】埋在地下的铸铁输油管道,在下列各种情况下,腐蚀最慢的是( )
A.在含铁元素较多的酸性土地中
B.在潮湿疏松的土地中
C.在干燥致密不透气的土地中
D.在含碳粒较多的潮湿透气中性土地中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3和K2CO3为电解质、以CH4为燃料,该电池的工作原理如下图所示,下列说法正确的是
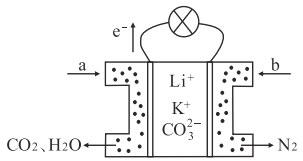
A. 电极a为负极,发生氧化反应 B. CO32-向正极移动
C. 正极电极反应式为O2+2H2O+4e-=4OH- D. 此电池在常温下也能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据不同原料,该药物合成路线通常有两条,其中以2-氯苯甲醛为原料的合成路线如下图所示:
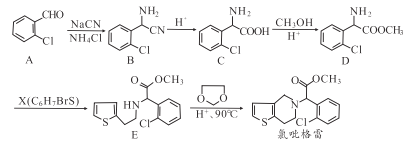
(1)分子A中非含氧官能团的名称为__________。
(2)X的结构简式为__________。
(3)分子C可在一定条件下反应生成一种含有3个六元环的产物,写出该反应的化学方程式__________。
(4)D-E的反应类型是__________。
(5)A的所有同分异构体(不包括A)中,同于芳香族化合物的有__种。
(6)已知: ![]() ,则由甲醇和乙醇为原料制备化合物
,则由甲醇和乙醇为原料制备化合物![]() 涉及的反应类型有_________ (填编号),写出制备化合物
涉及的反应类型有_________ (填编号),写出制备化合物![]() 最后一步反应的化学方程式_________。
最后一步反应的化学方程式_________。
①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol![]() L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
(3)滴定过程中,眼睛应注视_________________,若用酚酞作指示剂达到滴定终点颜色变化是____________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_____molL-1,烧碱样品的纯度是____(保留小数点后两位)
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____。
② 若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com