
过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1) 过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:
(2) Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
(3) 臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平 ) 回答问题:
① 还原产物的化学式为
② 配平后的化学方程式是
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
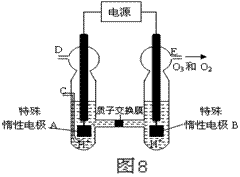

①图中阴极为 (填“A”或“B”)。
② 若C处不通入O 2 ,D、E处分别收集到11.2L和4.48L
气体(标准状况下), 则E处收集的气体中O3所占的体积分数
为 (忽略 O 3 的分解)。
③ 若C处通入O 2,则A极的电极反应式为: 。
(5)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如图9)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如图9)所示。由图可得出的正确说法是
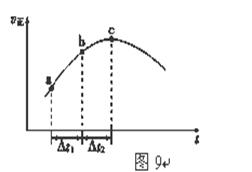
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.Δt1=Δt2时,NO的转化率:a~b段小于b~c段
【知识点】氧化还原反应原理、电解池原理、化学平衡 B3 F4 G3 G4
【答案解析】(1)H2O2+2H++2Fe2+=2Fe3++2H2O
(2)电子式 ( 略)
(3) KOH O3+2KI+H2O=2KOH+I2+O2
(4) ① A ②50% ③ O2+4H++4e-=2H2O
(5) d
解析:(1)过氧化氢是一种绿色氧化剂,在酸性条件下H2O2氧化氯化亚铁,H2O2的还原产物是水,Fe2+氧化成Fe3+,离子反应方程式:H2O2+2H++2Fe2+=2Fe3++2H2O
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,通过描述的过滤可制得,即可知道最适合的过氧化物是BaO2
(3)①由图可知,B极生成O2、O3,B极发生氧化反应,电解池阳极发生氧化反应,故A为阴极.
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O.
③若C处不通入O2,实质为电解水,D处为氢气,物质的量为11.2L÷22.4L/mol=0.5mol,E处为氧气、臭氧,物质的量共为22.4L÷22.4L/mol=1mo,令臭氧的物质的量为xmol,根据电子转移守恒有0.5mol×2=xmol×3×2+(0.2mol-xmol)×2×2,解得x=0.1,所以E处收集的气体中O3所占的体积分数为0.1mol÷0.2mol×100%=50%
(4)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明正反应为放热反应,c点以后正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡.
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,C点未达到平衡状态,故a错误;
b.反应未达平衡,b点在c点之前,反应物浓度:b点大于c点,故b错误;
c.该反应为放热反应,反应物的总能量高于生成物的总能量,故c错误;
d.a~b段反应速率小于b~c段反应速率,△t1=△t2时,b~c段反应的NO更多,故NO的转化率:a~b段小于b~c段,故d正确.
【思路点拨】本题考查了电解池反应原理、氧化还原反应计算、化学平衡图象、关键是阅读题目获取信息的能力,需要学生具备运用信息与基础知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
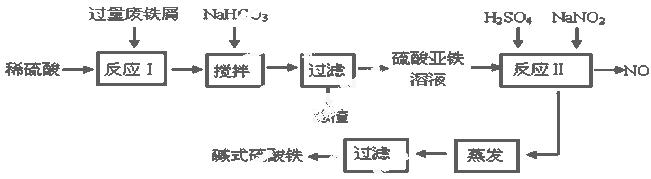
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 发生反应的离子方程式为
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的最佳试剂为 。
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
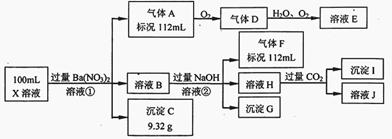
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。下列有关说法正确的是
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的原子物质的量之比为2:1
C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D. NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象
查看答案和解析>>
科目:高中化学 来源: 题型:
我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:
Br-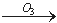 BrO-
BrO-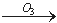 BrO2-
BrO2-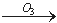 BrO3-,下列有关说法正确的是 ( )
BrO3-,下列有关说法正确的是 ( )
A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理
B.若改用氧气消毒,可避免生成溴酸盐
C.BrO3- 氧化性比O3强
D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生
查看答案和解析>>
科目:高中化学 来源: 题型:
硫、氯及其化合物由广泛的用途。
(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒的物质,CN-被氧化后的产物为_______________________(填化学式)。
(2)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl,生成的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氯胺能用于消毒杀菌的原因是___________________(用化学方程式表示)。
(3)如图所示装置和药品可用来制备Na2S2O3.

①H2CO3、H2S、H2SO3三种酸的酸性由强到弱的顺序为_________________.
②配平广口瓶中生成Na2S2O3反应的化学方程式:
()SO2+()Na2S+()Na2CO3——()Na2S2O3+()CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
现拟分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的结构简式。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com