
(һ)����2 mol SO2��1 mol O2������1L�������л�ϣ���һ�������·������·�Ӧ��2SO2(g)��O2 (g) 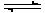 2SO3 (g)��������2s����SO3��Ũ��Ϊ0.6 mol/ L���Լ��㣺(1)O2�Ļ�ѧ��Ӧ����V(O2)= �� (2)2sʱ��O2Ũ�� ��
2SO3 (g)��������2s����SO3��Ũ��Ϊ0.6 mol/ L���Լ��㣺(1)O2�Ļ�ѧ��Ӧ����V(O2)= �� (2)2sʱ��O2Ũ�� ��
(��)��ij�¶�ʱ����2 L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯��������ͼ��ʾ��
��1��X��ת������
��2����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)= ��
��4������Ӧ���е��� min���÷�Ӧ�ﵽƽ�⡣
(1) �ԣ�O2)="0" .15mol/��L��s�� c(O2��=0.7 mol/L
(2) 30% 3X+Y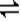 2Z 0.05mol/(l.��min) 2
2Z 0.05mol/(l.��min) 2
�������������(һ) 2s����SO3��Ũ��Ϊ0.6 mol/ L������V(O2)="0.5" V(SO2)=0.5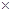 0.6/2=0 .15mol/��L��s����2sʱ��O2Ũ��=1-0 .15
0.6/2=0 .15mol/��L��s����2sʱ��O2Ũ��=1-0 .15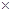 2=0.7 mol/L��
2=0.7 mol/L��
(��)��ͼ����֪����ÿ��Ӧ0.1molY����0.3molX��������0.2mol��Z,�����䷴Ӧ�Ļ�ѧ����ʽΪ3X+Y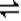 2Z�� X��ת����=0.3/1
2Z�� X��ת����=0.3/1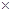 100%=30%����3����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)=0.2/2/2= 0.05mol/(l.��min)����4����ͼ���Կ���������Ӧʱ��Ϊ2minʱ�������ʵ�Ũ�Ⱦ����ٱ仯�����Ե���Ӧ���е���2min���÷�Ӧ�ﵽƽ�⡣
100%=30%����3����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)=0.2/2/2= 0.05mol/(l.��min)����4����ͼ���Կ���������Ӧʱ��Ϊ2minʱ�������ʵ�Ũ�Ⱦ����ٱ仯�����Ե���Ӧ���е���2min���÷�Ӧ�ﵽƽ�⡣
���㣺��ѧƽ�⣬��Ӧ����
���������⿼���˻�ѧƽ�⣬��Ӧ���ʵ���ؼ��㣬�Ǹ߿�������ص㣬�����ۺ���ǿ�����ѶȲ���


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?������һģ����a mol��Na2O2��bmol NaHCO3�����Ϻ����ܱ������м��ȵ�250�棬�����ַ�Ӧ������NaHCO3�ֽ������CO2��Na2O2��Ӧ���H2O����Na2O2��Ӧ��
��2012?������һģ����a mol��Na2O2��bmol NaHCO3�����Ϻ����ܱ������м��ȵ�250�棬�����ַ�Ӧ������NaHCO3�ֽ������CO2��Na2O2��Ӧ���H2O����Na2O2��Ӧ��| a |
| 2 |
| a |
| 2 |
| a |
| b |
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| a |
| b |
| 2 |
| 3 |
| 2 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013������ʡ��Ϫһ�и����ڶ����¿���ѧ�Ծ����������� ���ͣ������
(12��) �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI�� CO(g) �� 2H2(g)  CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII�� CO2(g) �� 3H2(g)  CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I������
����֪��Ӧ��������仯��ͼ��ʾ���ɱ��������ж� ��H1 0 �����������������������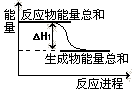
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol��L�� ��CO��ת����Ϊ
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H ����1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H ����566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H ����44.0 kJ��mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ________
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�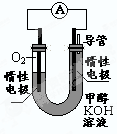
�ٸõ�������ĵ缫��ӦΪ____________
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ____________.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com