
【题目】已知25℃时,几种常见弱电解质的电离平衡常数如下表所示:
电解质 | H3PO4 | NH3·H2O | C6H5OH |
电离平衡常数 | K1=7.5×10-3 K2=7.5×10-8 K3=7.5×10-13 | 1.7×10-5 | 1.1×10-10 |
下列说法正确的是
A. NaH2PO4溶液呈碱性
B. 25℃时,0.1moL/L氨水的pH=11+lg1.7
C. 足量C6H5OH与Na3PO4反应的离子方程式为:2C6H5OH+PO43-=H2PO4-+2C6H5O-
D. 25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液中各离子浓度关系:c(C6H5O-)>c(NH4+)>c(OH-)>c(H+)
【答案】B
【解析】H2PO4-水解平衡常数是![]() ,H2PO4-水解平衡常数小于H3PO4的K1,电离大于水解,所以NaH2PO4溶液呈酸性,故A错误;设0.1moL/L氨水中c(OH-)=xmol/L,则
,H2PO4-水解平衡常数小于H3PO4的K1,电离大于水解,所以NaH2PO4溶液呈酸性,故A错误;设0.1moL/L氨水中c(OH-)=xmol/L,则![]() ,x=
,x=![]() moL/L, c(H+)=
moL/L, c(H+)=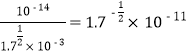 ,所以PH=11+lg1.7,故B正确;C6H5OH的电离平衡常数大于H3PO4的K3,小于H3PO4的K2,所以足量C6H5OH与Na3PO4反应的离子方程式为C6H5OH+PO43-=HPO42-+C6H5O-,故C错误;NH3·H2O电离程度大于C6H5OH,25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液呈碱性,各离子浓度关系c(NH4+)>c(C6H5O-)> c(OH-)>c(H+),故D错误。
,所以PH=11+lg1.7,故B正确;C6H5OH的电离平衡常数大于H3PO4的K3,小于H3PO4的K2,所以足量C6H5OH与Na3PO4反应的离子方程式为C6H5OH+PO43-=HPO42-+C6H5O-,故C错误;NH3·H2O电离程度大于C6H5OH,25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液呈碱性,各离子浓度关系c(NH4+)>c(C6H5O-)> c(OH-)>c(H+),故D错误。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol/L一元弱酸HA溶液中逐滴加入等浓度的NaOH 溶液,溶液中pH与pOH[pOH=-lgc(OH-) 的变化关系如右图所示。下列说法错误的是

A. 该温度下,水的离子积常数为1.0×10-2a
B. M、N 两点所示的溶液中,水的电离程度相同
C. Q点消耗的NaOH 溶液的体积等于HA 溶液的体积
D. N 点溶液加水稀释,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氧磷(POCl3)常用作半导体掺杂剂,实验室制取POCl3并测定产品质量的实验过程如下,据此回答下列问题:
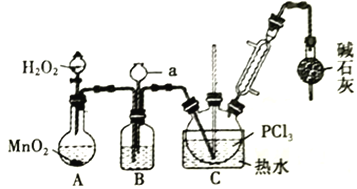
Ⅰ.氧化液态PCl3法制备POCl3:
资料i:有关试剂的性质及实验装置(加热及夹持装置省略)如下:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者均为无色液体,相互溶解;遇水均剧烈水解为两种酸。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)A 中反应时,MnO2的作用是_________________;仪器a的名称为_________________;
(2)盛有浓硫酸的装置B,其作用除观察O2的流速之外,还有_________________;
(3)实验时应控制反应温度在60~65℃,温度不宜过高的原因是_________________;;如果撤去装有碱石灰的干燥管,则可能降低POCl3的产量,原因是_________________________________(用化学方程式表示,任写一个)。
Ⅱ.沉淀滴定法测定POCl3质量:
资料ii :Ag3PO4为黄色沉淀,易溶于硝酸;
iii:Ag++SCN-=AgSCN↓,且Ksp(AgSCN) <Ksp(AgCl)。
实验步骤如下:
①将三颈烧瓶中的产品POCl3去除杂质,溶于60.00mL蒸馏水中,搅拌使其完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.8mol/L AgNO3标准溶液;
③加入少量硝基苯,用力摇动,使沉淀表面覆盖硝基苯;
④加入2~3 滴硫酸铁溶液作指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去10,00mL KSCN溶液。
(4)达到终点时的现象是______________________________;
(5)所得产品POCl3的质量为____________(结果保留两位小数);若取消步骤③,则所得结果将______________(填“ 偏高”、“ 偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题: I.将等物质的量的A、B混合放于2L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g).经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,v(C)=0.1mol/(Lmin).则:
(1)x= .
(2)前5min内B的反应速率v(B)= .
(3)平衡时A的转化率为 .
(4)II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)CO(g)+H2(g)△H. 已知:K(300℃)<K(350℃),则该反应是热反应.
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号. 
①缩小容器体积; ②降低温度
(6)已知反应①CO(g)+CuO(g)CO2(g)+Cu(s)②H2(g)+CuO(g)Cu(s)+H2O(g) 在相同的某温度下的平衡常数分别为K1和K2 , 该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=(用K1和K2表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学反应原理研究氮及其化合物意义重大。请回答下列问题:
(1)已知: N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_______。
(2)T1温度时,在容积为2 L 的恒容密闭容器中发生反应: 2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
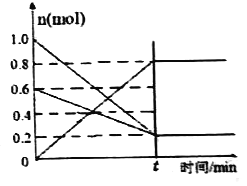
①下列说法能表明该反应已达到平衡状态的是______(填序号)。
A.混合气体的密度不变 B.混合气体的颜色不变
C. k正、k逆不变 D.2v正(O2)= v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系是K=_______。
③T1温度时,化学平衡常数K=______。将容器的温度改变为T2时,若k正=k逆 ,则T2___T1 (填“>”、“<”或“=”)。
(3) 亚硝酸是氮元素重要的含氧酸之一。25℃,测得amol/LHNO2稀溶液的pH=b,该温度下HNO2电离平衡常数的精确计算表达式为K=______(用含a、b的代数式表示)。将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合后,测得溶液pH=7,则溶液中![]() =_____(用含a 的代数式表示)。
=_____(用含a 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10﹣5 | K1=4.3×10﹣7 | K1=9.1×10﹣8 | K1=7.5×10﹣3 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸, ![]() 增大
增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com