
����Ŀ��һ�������ȶƹܷ���п����ZnSO4��7H2O���壬������ȡZnO����̽����缫��ѹ��ԭ����п��ⷨ��п�ķ���������������ͼ��ʾ��
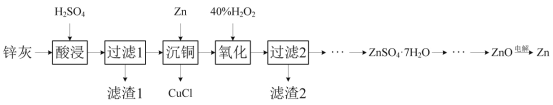
��֪����п�ҵ���Ҫ�ɷ�ΪZnO��ZnCl2��������SiO2��CuO��PbO��FeO��
��Cu++Cl-=CuCl��
�ش��������⣺
��1������1����Ҫ�ɷ�ΪSiO2��__��
��2�����ʱ��������Ũ�ȹ��ߣ����ܷ�������Ӧ�Ļ�ѧ����ʽΪ__��
��3��д������ͭ��ʱ�����ӷ���ʽ__��
��4����pHΪ5.6���������������ټ���۱�ϩ���������������Ƚ��裬��Ŀ����__��
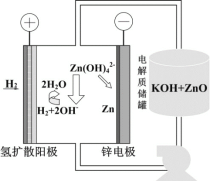
��5����缫��ѹ��ԭ����п��װ����ͼ��ʾ��������ZnO�ܽ���γ�Zn(OH)![]() ���ӣ�ÿ�ܽ�1molZnO������__molKOH�������е��ܷ�Ӧ���ӷ���ʽΪ��__��
���ӣ�ÿ�ܽ�1molZnO������__molKOH�������е��ܷ�Ӧ���ӷ���ʽΪ��__��
��6���ù��շ�ˮ�к���Zn2+���ŷ�ǰ�账�������ˮ�м���CH3COOH��CH3COONa��ɵĻ�����Һ����pH��ͨ��H2S������Ӧ��Zn2++H2S![]() ZnS(s)+2H+��������ķ�ˮ�в�������Ũ��Ϊ��
ZnS(s)+2H+��������ķ�ˮ�в�������Ũ��Ϊ��
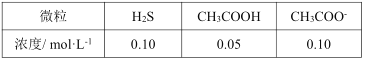
������ķ�ˮ��pH=__��c(Zn2+)=__��
����֪��Ksp(ZnS)=1.0��10-23��Ka1(H2S)=1.0��10-7��Ka2(H2S)=1.0��10-14��Ka(CH3COOH)=2.0��10-5��
���𰸡�PbSO4 2FeO+4H2SO4(Ũ)=Fe2(SO4)2+SO2��+4H2O Zn+2Cu2++2Cl-=2CuCl��+Zn2+ ��ʹFe(OH)3����۳��������ڹ��˷��� 2 H2+Zn(OH)42-![]() 2H2O+Zn+2OH- 5 1��10-11mol��L-1
2H2O+Zn+2OH- 5 1��10-11mol��L-1
��������
п��(��Ҫ�ɷ���ZnO��ZnCl2��������SiO2��CuO��PbO��FeO��)���������������PbOת����PbSO4������SiO2���������ˮ������˵õ�������1��ҪΪPbSO4��SiO2����Һ����ZnSO4��FeSO4��CuSO4��H2SO4������Һ�м���Zn�ۣ���Cu2+��ԭ��������CuCl�����ﵽ��ͭ��Ŀ�ģ���������Һ�м���˫��ˮ��Fe2+������Fe3+���ټ���ZnO������ҺpH����Fe3+ת���������������������˳�ȥ������Һ������Ũ������ȴ�ᾧ�����˵õ�ZnSO47H2O����Һ��������������Һ������������п�����ȷֽ���������п�����������Zn���Դ˽����⡣
(1)����֪������1����Ҫ�ɷ�ΪSiO2��PbSO4��
(2)Ũ������ǿ�����ԣ����ʱ����ʹ������Ũ�ȹ��ߣ����ܽ�ʱ������FeO����Fe3+��ͬʱ����SO2����Ⱦ������������Ӧ�Ļ�ѧ����ʽΪ2FeO+4H2SO4(Ũ)=Fe2(SO4)2+SO2��+4H2O��
(3)����ͭ��ʱ����Zn�ۣ���Cu2+��ԭ��������CuCl������������Ӧ�����ӷ���ʽΪZn+2Cu2++2Cl-=2CuCl��+Zn2+��
(4)��pHΪ5.6�����������������ɵ�Fe3+ˮ�����������������壬��������۱�ϩ���������������Ƚ��裬�ɴ�ʹFe(OH)3����۳��������ڹ��˷��룻
(5)������ZnO�ܽ���γ�Zn(OH)![]() ���ӣ����������ӷ�Ӧ2OH����ZnO��H2O��Zn(OH)
���ӣ����������ӷ�Ӧ2OH����ZnO��H2O��Zn(OH)![]() ����ÿ�ܽ�1molZnO��������2molKOH�����������ϵ�H2�ڼ���������ʧ������������H2O���缫��ӦΪH2-2e-+2OH-=2H2O��������Zn(OH)
����ÿ�ܽ�1molZnO��������2molKOH�����������ϵ�H2�ڼ���������ʧ������������H2O���缫��ӦΪH2-2e-+2OH-=2H2O��������Zn(OH)![]() ���ӵõ��ӻ�ԭ����Zn���缫��ӦʽΪZn(OH)
���ӵõ��ӻ�ԭ����Zn���缫��ӦʽΪZn(OH)![]() +2e-=Zn+4OH-��������е��ܷ�Ӧ���ӷ���ʽΪH2+Zn(OH)42-
+2e-=Zn+4OH-��������е��ܷ�Ӧ���ӷ���ʽΪH2+Zn(OH)42-![]() 2H2O+Zn+2OH-��
2H2O+Zn+2OH-��
(6)��֪Ka(CH3COOH)= =
=![]() =2.0��10-5����c(H+)=1��10-5mol/L����ʱ��ҺpH=5��Ka2(H2S)��Ka1(H2S)=
=2.0��10-5����c(H+)=1��10-5mol/L����ʱ��ҺpH=5��Ka2(H2S)��Ka1(H2S)=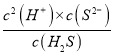 =1.0��10-7��1.0��10-14������c(H+)=1��10-5mol/L��c(H2S)=0.10mol/L����c(S2-)=1.0��10-12 mol/L����ʱKsp(ZnS)=1.0��10-23=c(Zn2+)��c(S2-)����c(Zn2+)=1��10-11mol��L-1��
=1.0��10-7��1.0��10-14������c(H+)=1��10-5mol/L��c(H2S)=0.10mol/L����c(S2-)=1.0��10-12 mol/L����ʱKsp(ZnS)=1.0��10-23=c(Zn2+)��c(S2-)����c(Zn2+)=1��10-11mol��L-1��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������ͼ����װ�ý���������ˮ������Ӧ����ʵ�飬�����ò����һ����ȡFeCl3��6H2O���塣��ͼ�мгּ�β������װ�þ�����ȥ��
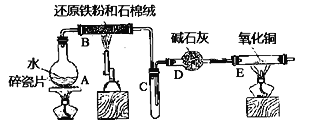
�ش��������⣺
��1��װ��B�з�����Ӧ�Ļ�ѧ����ʽ��__________
��2��E���______________������
��3����С���B�з�Ӧ��IJ���������������ᣬ�ø���Һ��ȡFeCl3��6H2O���塣
����������Һ�к���Fe3+��ѡ�õ��Լ�Ϊ____________��������__________
�ڸ�ʵ��С��ͬѧ�������Լ�û�м�Fe3+�������ӷ���ʽ������Һ�в�����Fe3+���ܵĵ�ԭ��___________��
�۽�����Һ��FeCl2��ȫ����ΪFeCl3���ѡ��_______����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɽԺʿָ����ʵ��֤����ҩ�����������Ҷ������¹ڷ�����������Ч��G������Чҩ���ɷ�֮һ��������ͼת����ϵ��

�����й�˵����ȷ����
A.�������������̼ԭ�ӿ��ܶ�����
B.��������������3������̼ԭ��
C.������G������ܷ���������Ӧ��ȡ����Ӧ����ȥ��Ӧ
D.���ڷ�Ӧ�У�G��ˮ��1��1������Ӧ����G�ķ���ʽΪC16H20O10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Anammox����һ�����͵İ���ȥ������������˵��������ȷ����
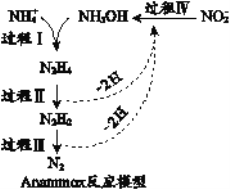
A. 1mol NH4+ ��������������Ϊ10NA
B. ������N2H4���к��м��Լ��ͷǼ��Լ�
C. ����II����������Ӧ������IV���ڻ�ԭ��Ӧ
D. ����I�У����뷴Ӧ��NH4+��NH2OH�����ʵ���֮��Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��������Ԫ���м۲�ɶԵ��������̬Mg�۲�ɶԵ�������ȵ�Ԫ����_________�֡�
(2)����(ƽ���νṹ���ṹʽΪ![]() )��Nԭ���ӻ���ʽΪ______����ԭ�ӷ����еĴ��������÷���
)��Nԭ���ӻ���ʽΪ______����ԭ�ӷ����еĴ��������÷���![]() ��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ����������������еĴ�����Ӧ��ʾΪ_______��
��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ����������������еĴ�����Ӧ��ʾΪ_______��
(3)һ���̵�������ľ�����ͼ�ף���д����������Ļ�ѧʽ______������z�᷽��۲�þ������ɵ�ͶӰͼ��ͼ�ң��뻭����y�᷽���ͶӰͼ______��

(4)ij��Mg���⾧�崢���ת��ΪMgH2��MgH2����Ľṹ��ͼ������������a=b=450pm��c=301pm��ԭ�ӷ�������ΪA(0��0��0)��B(0.305��0.305,0)��C(1��1��1)��D(0.195��0.805��0.5)��

�ٸþ�����Mg����λ����__________��
��Mg2+�İ뾶Ϊ72pm����H���İ뾶Ϊ____________pm(�г��������ʽ)
����NA��ʾ����٤����������MgH2����������ܶ��DZ�״���������ܶȵ�_______��(�г��������ʽ�������ܶ�Ϊ0.089g��L��1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȡ���Ĺ�����������ͼ��ʾ���ش��������⣺

(1)����X��___________(�ѧʽ)��
(2)д����Ӧ�١���Ӧ�ڵ����ӷ���ʽ��
��_________________________________����_________________________________��
(3)����1�Ͳ���2����_____________���ò���Ҫ�õ��IJ��������ǣ�_______��____��_______��
(4)����ʯ��������_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȷ��ȡ6.00����������Ʒ����Al2O3��Fe2O3��SiO2�����������ʢ��100����H2SO4��Һ���ձ��У���ַ�Ӧ���˳����������ҺX�м���10Ħ/����NaOH��Һ�������ij���������w������NaOH��Һ�����V֮������ͼ��ʾ�Ĺ�ϵ����
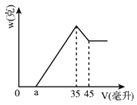
��1������ͼ���֪��ҺX�������е����ʳɷ�Ϊ_____���ѧʽ����
��2��H2SO4��Һ�����ʵ���Ũ����__________��
��3��ͼ��aֵΪ2.3����ʱ����������Ʒ��Fe2O3����������_________________��
��4��aֵ�ı仯��Χ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£��̶��ݻ��������м���a mol A��b mol B��������Ӧ��
A(g)+2B(g)![]() 2C(g)һ��ʱ���ﵽƽ�⣬����n mol C��������˵���в���ȷ����
2C(g)һ��ʱ���ﵽƽ�⣬����n mol C��������˵���в���ȷ����
A���ٳ�������A��ƽ��������Ӧ�����ƶ�����Kֵ����
B����ʼʱ�̺ʹﵽƽ��������е�ѹǿ֮��Ϊ(a+b)��(a+b��![]() )[
)[
C����2v��(A)=v��(B)ʱ����Ӧһ���ﵽƽ��״̬
D�������������(��Ar)����ѹǿ��ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ���ҽ����������������ת��ʵ�顣
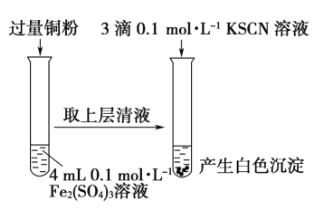
ʵ��������![]() ת��Ϊ
ת��Ϊ![]()
�������ϣ�
��֪����![]() �Ļ�ѧ������
�Ļ�ѧ������![]() ����
����
��![]()
ʵ��������![]() ת��Ϊ
ת��Ϊ![]()
ʵ�鷽�� | ���� |
�� | ��Һ��Ϊ��ɫ������һ��ʱ�����ɫ��ʧ����Һ��Ϊ��ɫ |
�������ϣ�![]() (��ɫ)
(��ɫ)
����˵������ȷ����
A.ȡ![]() ��Һ�������еμ�3��
��Һ�������еμ�3��![]() ��Һ��������ɫ����
��Һ��������ɫ����
B.ȡ![]() ��Һ�������еμ�3��
��Һ�������еμ�3��![]() ��Һ��������ɫ����
��Һ��������ɫ����
C.![]() ��
��![]() ��Ӧ�����ӷ���ʽΪ
��Ӧ�����ӷ���ʽΪ![]()
D.����![]() ��ԭ��
��ԭ��![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com