
 在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 醋酸中逐滴加入氢氧化钠溶液 | ||
| C. | 氢氧化钡溶液中逐滴加入硫酸溶液 | D. | 醋酸中逐滴加入氨水 |
分析 溶液的导电性与溶液中离子浓度大小和离子所带电荷数有关系,据此可以解答.
解答 解:A.食盐溶液中逐滴加入盐酸,二者不反应,溶液中离子浓度增大,导电性增强,故A错误;
B.醋酸中逐滴加入氢氧化钠溶液生成醋酸钠,醋酸钠为强电解质,导电性增强,故B错误;
C.氢氧化钡溶液中逐滴加入硫酸生成硫酸钡白色沉淀和水,溶液中离子浓度减小,因此灯泡由亮变暗至熄灭.硫酸过量后,溶液中离子浓度又逐渐增大,所以灯泡又逐渐变亮,符合题目要求,故C正确;
D.醋酸中逐滴加入氨水,生成醋酸铵,醋酸铵为强电解质,导电性增强,故D错误.
故选C.
点评 本题考查电解质溶液的导电性,题目难度不大,注意灯泡熄灭,说明完全反应时溶液电荷浓度接近0,根据反应物进行判断.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeCl3溶液中,Fe3+的物质的量一定小于0.1NA | |
| B. | 6.6gCO2分子中含的共用电子对数为0.6NA | |
| C. | 标准状况下,22.4LNO和11.2L02混合后气体的分子总数为NA | |
| D. | 6.4g铜与足量的硫充分反应,则转移的电子教为0.2N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
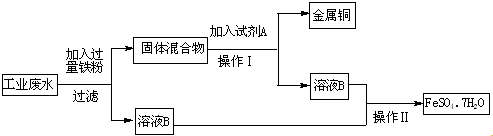
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K +、SiO32-、OH -、Na + | B. | Na +、H +、CO32-、SO42- | ||
| C. | K +、H +、SiO32-、Cl - | D. | OH -、Na +、HCO3-、Cl - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com