
25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
|
| A. | 均存在电离平衡和水解平衡 |
|
| B. | 存在的粒子种类相同 |
|
| C. | c(OH﹣)前者大于后者 |
|
| D. | 分别加入NaOH固体,恢复到原温度,c(CO32﹣)均增大 |
考点:
盐类水解的应用.
专题:
盐类的水解专题.
分析:
A、任何溶液中均存在水的电离平衡,在水溶液中碳酸氢根存在电离平衡和水解平衡;
B、根据溶液中存在的微粒来回答;
C、碳酸根的水解程度大于碳酸氢根,水解规律:谁强显谁性;
D、碳酸氢根和氢氧根在溶液中不共存.
解答:
解:A、Na2CO3溶液中存在水的电离平衡和碳酸根的水解平衡,NaHCO3在水溶液中存在碳酸氢根的电离平衡和水解平衡以及水的电离平衡,故A正确;
B、NaHCO3和Na2CO3溶液中存在的微粒均为:钠离子、碳酸根、碳酸氢根、氢氧根、氢离子、碳酸分子、水分子,存在的粒子种类相同,故B正确;
C、碳酸根的水解程度大于碳酸氢根,二者水解均显碱性,跟据水解规律:谁强显谁性,所以碳酸钠中的氢氧根浓度大于碳酸氢钠溶液中的氢氧根浓度,故C错误;
D、分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用,所以c(CO32﹣)均增大,故D正确.
故选:C.
点评:
本题考查学生盐的水解的应用,可以根据所学知识进行回答,难度不大.


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中,pH最大的是( )
|
| A. | Na2CO3溶液 | B. | NH4HCO3溶液 | C. | NaHCO3溶液 | D. | NaHSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 按系统命名法, |
|
| B. | 实验证实化合物 |
|
| C. | 能用新制的氢氧化铜鉴别乙醛与葡萄糖溶液 |
|
| D. | 化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水的电离达到平衡:H2O⇌H++OH﹣△H>0,下列叙述正确的是( )
|
| A. | 向水中加入氨水,平衡逆向移动,c(OH﹣)降低 |
|
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
|
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
|
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图反应是有名的Diels﹣Alder反应的一个著名化学反应方程式:分析上述有机化学反应,可判断其反应的类型是( )
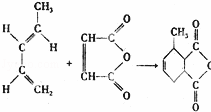
|
| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.某烃的结构简式为CH3C(CH3)2CH2CH(C2H5)CH2CH3
(1)该烃的名称为 ;
(2)若该烃是由某烯烃(含一个碳碳双键)和氢气加成而来,则烯烃的结构有 种;(3)若该烃是由某炔烃(含一个碳碳三键)和足量氢气加成而来,则炔烃的名称
为 炔 .
Ⅱ.同分异构现象是有机物种类繁多的原因之一,C10H14的同分异构体甚多,在苯的同系物的同分异构体中:
(1)苯环上只有一个烃基的同分异构体有 种;
(2)苯环上只有二个烃基的同分异构体有 种;
(3)苯环上只有三个烃基的同分异构体有 种;
(4)苯环上只有四个烃基的同分异构体有 种;
Ⅲ.苯分子中的氢原子分别被氟、氯、溴原子所取代得到C6H3BrClF分子的同分异构体有 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:R﹣OH+R﹣OH R﹣O﹣R(醚)+H20,分子式为C2H6O和C3HsO醇的 混合物在一定条件下脱水形成的醚最多有( )
R﹣O﹣R(醚)+H20,分子式为C2H6O和C3HsO醇的 混合物在一定条件下脱水形成的醚最多有( )
|
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)电镀是将镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法: 。
(3)酸浸法制取硫酸铜的流程示意图如下:

①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为 。
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1molMnO2转移2 mol电子,该反应的离子方程式为:
。
④步骤(iv)除去杂质的化学方程式可表示为
3Fe3++NH4++2SO42-+6H2O=NH4Fe3(SO4)2(OH)6↓+6H+,过滤后母液的pH=2.0,
c(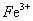 )=a mol·L—1,c(
)=a mol·L—1,c( )=b mol·L—1,c(
)=b mol·L—1,c(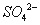 )=d mol·L—1,
)=d mol·L—1,
该反应的平衡常数K= (用含a、b、d的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com