
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(1)FeCl3蚀刻铜箔反应的离子方程式为_____________________________________。
(2)过程Ⅰ加入铁屑的主要作用是________________________________________________________________________,
分离得到的固体主要成分是________________________________________________________________________,
从固体中分离出铜需采用的方法是________________________________________________________________________。
(3)过程Ⅱ中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
根据2CrO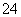 +2H+Cr2O
+2H+Cr2O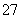 +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为________________________________________________________________________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为________________________________________________________________________。
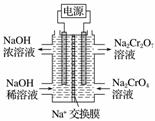
查看答案和解析>>
科目:高中化学 来源: 题型:
关于FeCl3进行的实验,下列预测正确的是( )
| 选项 | 实验 | 预测 |
| A | 蒸发FeCl3溶液 | 得到FeCl3固体 |
| B | 在FeCl3、CuCl2混合液中,加入少量Fe粉 | 一定有H2产生且有Cu析出 |
| C | 用FeCl3固体溶于水配制饱和溶液 | 会有Fe(OH)3沉淀产生 |
| D | 在FeCl3溶液中加入KHCO3溶液 | 有CO2产生,但无Fe(OH)3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一块铁的“氧化物”样品,用140 mL 5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限。
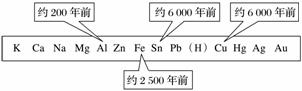
根据上图回答下列问题。
(1)铝是地壳中含量最高的金属元素,为什么人类对铝的使用比铁、铜晚得多?
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物是中学化学中的一类重要物质,下列关于铁元素的叙述中正确的是( )
A.2Fe3++Fe===3Fe2+成立说明氧化性:Fe3+>Fe2+
B.25 ℃,pH=0的溶液中,Al3+、NH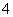 、NO
、NO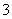 、Fe2+可以大量共存
、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL浓度为2mol/L的盐酸跟过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是 ( )
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量醋酸钠固体 D.加入适量的氯化钠固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com