
【题目】下列物质的分类组合全部正确的是( )
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | NaCl | H2O | Cl2 |
B | H2SO4 | CaCO3 | CCl4 |
C | AgCl | HClO | Cu |
D | Ba(OH)2 | H2S | C2H5OH |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。下列关于海洋氮循环的说法正确的是
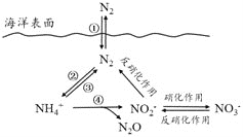
A. 海洋中的氮循环起始于氮的氧化
B. 海洋中的氮循环属于固氮作用的是③
C. 海洋中的反硝化作用一定有氧气的参与
D. 向海洋排放含NO3—的废水会影响海洋中NH4+的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下面10种元素,完成以下各小题。
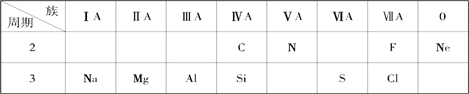
(1)金属性最强的元素是________(填名称);化学性质最不活泼的元素是________(填元素符号)。
(2)S 原子结构示意图为___________;
(3)除Ne以外的其余九种元素的原子中,原子半径最小的是___________(填元素符号);
(4)元素硅的氧化物常用于制造___________(填一种高性能的现代通讯材料的名称);
(5)氮元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型为_______________;氮元素的氢化物与氯元素的氢化物能生成盐W,W的电子式为____________________。
(6)元素最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),呈两性的是_________(填化学式);两者反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是

A. 反应在0~10 s内,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 反应在0~10 s内,X的物质的量浓度减少了0.79 mol·L-1
C. 反应进行到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)≒Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同, 有关玻璃态水的叙述正确的是( )
A. 水由液态变为玻璃态,体积一定缩小
B. 玻璃态水不可能加工为规则的外形
C. 玻璃态水中水分子间的作用力与冰中不完全相同
D. 玻璃态水是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答如下有关大气污染处理的相关问题。
(1)汽车发动机工作时常会产生NO2,其中主要反应的能量变化如图所示:

①写出N2和O2反应的热化学方程式:_______________。
②常温下NH3可与NO2直接反应实现无害转化。写出用此法治理n(NO):n(NO2)=1:1时反应(可逆)的化学方程式__________________;已知该反应ΔH<0,写出既能加快反应速率又能提高氮氧化物的转化率的措施之一:_________________。
(2)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) ![]() 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容恒温密闭容器中通入2molCO,测得CO2的物质的量分数[φ(CO2)]随时间t变化曲线如下图所示:
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容恒温密闭容器中通入2molCO,测得CO2的物质的量分数[φ(CO2)]随时间t变化曲线如下图所示:

①T1温度下,0.5min内CO2的平均速率为_______________。
T2温度下,化学平衡常数K=_________________。
②a点时,向容器中再冲入2molCO,再次达到平衡后,φ(CO2)_______________(填“增大”、“减小”或“不变”
(3)利用I2消除SO2污染的工业流程如下:

①反应器中反应的离子方程式:______________________。
②用化学平衡移动的原理分析,使用膜反应器及时分离出H2的目的是:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com