
| A. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 10 L pH=1的硫酸溶液中含有的H+为2NA | |
| D. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
分析 A.溶液体积未知;
B.依据原子个数守恒解答;
C.pH=1硫酸溶液中氢离子物质的量浓度为0.1mol/L;
D.物质的量浓度中体积为溶液的体积.
解答 解:A.溶液体积未知,无法计算溶液中离子个数,故A错误;
B.1mol硝酸铵中含有2mol氮原子,所以1 L 0.1 mol•L-1的NH4NO3溶液中含有硝酸铵的物质的量为0.1mol,氮原子数为0.2NA,故B正确;
C.10 L pH=1的硫酸溶液中含有的H+为0.1mol/L×1L×NA=NA,故C错误;
D.可将58.5 g NaCl溶于1.00 L水中,溶液体积大于1L,溶液浓度小于 1.00 mol•L-1,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意物质的量浓度概念的理解,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | Br-Br | H-Br |
| 键能/(kJ•mol-1) | 436 | 193 | 366 |
| A. | +103 kJ•mol-1 | B. | +679 kJ•mol-1 | C. | -103 kJ•mol-1 | D. | +183 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
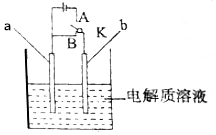 用如图所示装置进行实验,请回答下列问题:
用如图所示装置进行实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
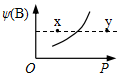 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁与浓硝酸 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18mol/L硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 mL 1 mol•L-1 FeCl3溶液中含有Fe3+数目小于0.1NA | |
| B. | 1 mol-OH和17 g NH3所含的电子数相等 | |
| C. | 标准状况下,2.24 L Cl2与过量铁粉反应,转移的电子总数为2NA | |
| D. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑧ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与足量二氧化碳反应转移的电子数为2 NA | |
| B. | 标准状况下22.4L CCl4所含的原子数为5NA | |
| C. | 56g Fe与任何物质完全反应时转移的电子数一定为2NA | |
| D. | 1mol镁与足量氧气或氮气反应均失去2NA的电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com