
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 3 | ② | ③ | ⑧ | ⑩ | ||||
| 4 | ① | ⑨ |
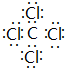 ,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为
,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为 .
.分析 由元素在周期表中的位置可知,①为K,②为Mg,③为Al,④为C,⑤为N,⑥为O,⑦为F,⑧为Cl,⑨为br,⑩为Ar.
(1)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大;非金属性越强,对应氢化物越稳定性;最高价氧化物对应的水化物中酸性最强的是高氯酸;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(2)④与⑧元素组成的分子为CCl4;根据共用电子对是否偏移判断共价键极性;⑤元素形成的单质为N2,分子中N原子之间形成3对共用电子对;⑧元素形成简单离子为Cl-,核外电子数为18,有3个电子层,各层电子数为2、8、8;
(3)②与⑧形成的化合物为MgCl2,属于离子化合物,溶于水电离出镁离子、氯离子;
(4)金属性越强,最高价氧化物对应的水化物碱性越强;元素①单质和⑥的氢化物反应是K与水反应生成KOH与氢气;
(5)元素非金属性越强,阴离子还原性越弱.
解答 解:由元素在周期表中的位置可知,①为K,②为Mg,③为Al,④为C,⑤为N,⑥为O,⑦为F,⑧为Cl,⑨为br,⑩为Ar.
(1)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,F原子半径最小;F元素非金属性最强,故HF最稳定;最高价氧化物对应的水化物中酸性最强的是HClO4;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,简单阳离子半径最小的是Al3+,
故答案为:F;HF;HClO4;Al3+;
(2)④与⑧元素组成的分子为CCl4,电子式为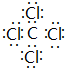 ,含有的化学键为极性键,⑤元素形成的单质为N2,分子中N原子之间形成3对共用电子对,结构式为N≡N;⑧元素形成简单离子为Cl-,核外电子数为18,有3个电子层,各层电子数为2、8、8,离子结构示意图为
,含有的化学键为极性键,⑤元素形成的单质为N2,分子中N原子之间形成3对共用电子对,结构式为N≡N;⑧元素形成简单离子为Cl-,核外电子数为18,有3个电子层,各层电子数为2、8、8,离子结构示意图为 ,
,
故答案为: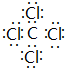 ;极性;N≡N;
;极性;N≡N; ;
;
(3)②与⑧形成的化合物为MgCl2,属于离子化合物,溶于水电离出镁离子、氯离子,溶于水所克服的微粒间作用力为离子键,
故答案为:离子键;
(4)①②③几种元素中K的金属性最强,故最高价氧化物对应的水化物中KOH碱性最强;元素①单质和⑥的氢化物反应是K与水反应生成KOH与氢气,反应方程式为:2K+2H2O=2KOH+H2↑,
故答案为:KOH;2K+2H2O=2KOH+H2↑;
(5)非金属性F>Cl>Br,元素非金属性越强,阴离子还原性越弱,故离子还原性:Br->Cl->F-,
故答案为:Br->Cl->F-.
点评 本题考查位置结构性质的应用,熟练掌握元素周期表的结构,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .按pH值由大到小顺序排列正确的是( )
.按pH值由大到小顺序排列正确的是( )| A. | ④①③② | B. | ①④③② | C. | ①②③④ | D. | ④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol/L | B. | 0.6 mol/L | C. | 0.8 mol/L | D. | 1.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 | |
| B. | 只有非金属元素才能形成含氧酸盐 | |
| C. | 主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同 | |
| D. | 非金属元素的最高价含氧酸都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极上Fe发生还原反应 | |
| B. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 | |
| C. | 放电时,Ni(OH)2是还原产物 | |
| D. | 该蓄电池放电过程和充电过程发生的是可逆反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com