
分析 (1)pH=5的NaHSO4溶液中,水的电离c(H+)=10-9mol/L,pH=9的NH3•H2O中水的电离c(H+)=10-9mol/L;
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,反应生成硫酸钠、硫酸铵,铵根离子水解显酸性;PH=7,由电荷守恒分析离子浓度关系;用硫酸氢钠与氢氧化钡溶液制取硫酸钡,硫酸根离子完全沉淀,则二者以1:2反应,生成硫酸钡、NaOH;
(3)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性;
(4)①溶液中溶质浓度相同,氢氧化钠是强碱,电离产生氢氧根离子,pH最大,盐中阳离子相同,酸越弱,其盐的酸根水解程度越大,据此解答.
②根据是否存在平衡分析判断,不存在平衡的pH值变化大;
③碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳;
④HCO3-、AlO2-之间反应.
解答 解:(1)pH=5的NaHSO4溶液中,水的电离c(H+)=10-9mol/L,pH=9的NH3•H2O中水的电离c(H+)=10-9mol/L,则两溶液中水的电离程度相等,
故答案为:=;
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,反应生成硫酸钠、硫酸铵,铵根离子部分水解溶液显酸性,水解离子反应为:NH4++H2O?NH3•H2O+H+;
pH=7,氢离子与氢氧根离子浓度相等,由电荷守恒可知离子浓度关系为:c(Na+)+c(NH4+)=2c(SO42-);
用硫酸氢钠与氢氧化钡溶液制取硫酸钡,硫酸根离子完全沉淀,则二者以1:2反应,生成硫酸钡、NaOH,溶液显碱性,溶液的pH>7,
故答案为:NH4++H2O?NH3•H2O+H+;=;>;
(3)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性,溶液中电荷守恒分析,离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)①.①、②、③、④是盐,⑤是碱,浓度相同,碱的PH值最大,①、②、③、④四种盐的阳离子相同,其阴离子对应的酸越弱,酸根的水解程度越大,酸性:醋酸>碳酸>碳酸氢根>偏铝酸,浓度相同,酸根的水解程度越大,pH值越大,故pH为④<②<①<③<⑤,故答案为:④<②<①<③<⑤.
②.①②③④都存在水解平衡,当稀释时,盐的弱酸根又水解出部分离子进行补充;氢氧化钠是强碱,完全电离,不存在电离平衡,所以当稀释时,其pH变化最大;
故答案为:⑤;
③碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳,NaAlO2与氯化铝发生双水解反应生成氢氧化铝沉淀,CH3COONa与氯化铝不反应,NaOH与氯化铝反应生成氢氧化铝沉淀,故答案为:①②;
④NaHCO3、NaAlO2的阴离子之间能反应,即HCO3-+AlO2-+H2O═Al(OH)3↓+CO32-,故答案为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32-.
点评 本题考查了溶液中的离子浓度大小比较,题目难度中等,试题涉及盐类水解、电离、离子之间的反应等知识点,综合性较强,充分考查了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 纤维素 涤纶 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 淀粉 聚异戊二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
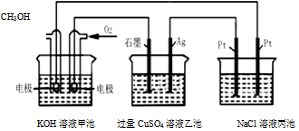
| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g | |
| D. | 反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com