

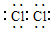 ,M的学化式为NaClO.
,M的学化式为NaClO.分析 海水晒盐利用氯化钠溶解度随温度变化不大得到粗盐和母液,粗盐精制除杂得到精盐,电解饱和食盐水得到氢氧化钠、氢气和氯气,则C为Cl2,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯气和氢气反应生成N为HCl,贝壳煅烧生成A为氧化钙,氧化钙溶于水生成B为氢氧化钙,加入母液中测定镁离子生成氢氧化镁沉淀,过滤壶沉淀中加入盐酸溶解得到氯化镁溶液,浓缩结晶干燥得到固体氯化镁,电解熔融氯化镁生成镁和氯气,
(1)物质C和M均为强氧化性物质,分析判断C为Cl2,M为NaClO;
(2)反应⑤电解熔融氯化镁生成镁和氯气;
(3)滴入的溶液能氧化碘离子生成单质碘;
解答 解:海水晒盐利用氯化钠溶解度随温度变化不大得到粗盐和母液,粗盐精制除杂得到精盐,电解饱和食盐水得到氢氧化钠、氢气和氯气,则C为Cl2,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯气和氢气反应生成N为HCl,贝壳煅烧生成A为氧化钙,氧化钙溶于水生成B为氢氧化钙,加入母液中测定镁离子生成氢氧化镁沉淀,过滤壶沉淀中加入盐酸溶解得到氯化镁溶液,浓缩结晶干燥得到固体氯化镁,电解熔融氯化镁生成镁和氯气,
(1)物质C和M均为强氧化性物质,分析判断C为Cl2,氯原子间形成一对共用电子对,则C的电子式为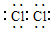 ,M为NaClO,溶液中次氯酸根离子有氧化性,
,M为NaClO,溶液中次氯酸根离子有氧化性,
故答案为: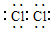 ;NaClO;
;NaClO;
(2)电解熔融氯化镁生成镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(3)向海带灰溶解后的滤液中先滴入几滴稀硫酸,然后加入一定量的溶液X具有氧化性能氧化碘离子生成碘单质,选项中过氧化氢在酸溶液中具有氧化性能氧化碘离子,氯气能氧化碘离子生成碘单质,故选BD,
故答案为:BD.
点评 本题考查了从海水中提取镁的反应原理、粗盐提纯后的烧碱工业和产物应用,利用所学知识结合流程图信息是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 上述反应,每生成lmolN2O,消耗67.2LCO | |
| B. | 等物质的量的NO和CO含有相等的电子数 | |
| C. | N2O只有氧化性,无还原性 | |
| D. | CO会迅速与人体血红蛋白结合,使人中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,钠离子核外能量最高的电子位于2p层,比较离子半径大小:r(Na+)<r(O2-)(填“>”,“<”或“=”)
,钠离子核外能量最高的电子位于2p层,比较离子半径大小:r(Na+)<r(O2-)(填“>”,“<”或“=”) ,
,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是一种重要的物质,可用于制取化肥和硝酸等.
氨气是一种重要的物质,可用于制取化肥和硝酸等.| N-H | H-H | N≡N | |
| 断开1mol化学键需要吸收的能量/kJ | a | 436 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;C2B2的电子式为
;C2B2的电子式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com