
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素回答下列问题:

(1)元素d在周期表中的位置是_____________,h与f原子序数相差______________。
(2)b、c、f的简单离子半径最小的是___________(填离子符号),原子半径最小的是______(填化学式)。
(3)表中第三周期元素的非金属性最强是_________(用元素符号表示), e、f、g三种元素的气态氢化物最不稳定的是__________(用化学式表示)。
(4)g元素与b元素的最高价氧化物对应水化物反应的化学方程式为________________________。
【答案】(1)第三周期IIIA族(2分),18(2分)。(2)Mg2+(1分),S(1分)。
(3)Cl(1分),PH3(1分)(4)NaOH+HClO4=NaClO4+H2O(2分)。
【解析】试题分析:根据元素在周期表中的位置可知a是N,b是Na,c是Mg,d是Al,e是P,f是S,g是Cl,h是Se。
(1)元素Al在周期表中的位置是第三周期IIIA族,h与f原子序数相差34-16=18。
(2)核外电子排布相同的离子,离子半径随原子序数的增大而减小,离子的核外电子层数越多,离子半径越大,则b、c、f的简单离子半径最小的是Mg2+。同周期自左向右原子半径逐渐减小,则原子半径最小的是S。
(3)表中第三周期元素的非金属性最强是Cl。同周期自左向右非金属性逐渐增强,氢化物稳定性逐渐增强,则e、f、g三种元素的气态氢化物最不稳定的是PH3。
(4)g元素与b元素的最高价氧化物对应水化物反应的化学方程式为NaOH+HClO4=NaClO4+H2O。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】完成下列问题。
Ⅰ.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
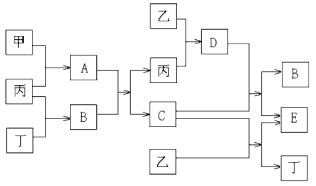
(1)A和E的化学式分别为____________、_____________;
(2)A+B → C+丙的化学方程式:____________________________;
(3)D+C → B+E的离子方程式:________________________________;
(4)1 mol甲和1 mol乙混合投入到足量的B中,在标准状况下,最多能产生________L丁气体。
Ⅱ.在标准状况下,取甲、乙、丙各30mL相同浓度的盐酸,然后分别慢慢加入组成相同的铝镁混合物,得下表中有关数据(反应前后溶液体积不发生变化)。
实验序号 | 甲 | 乙 | 丙 |
混合物质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸__________(填“过量”、“适量”或“不足”);
乙组实验中,盐酸__________(填“过量”、“适量”或“不足”)。
(2)盐酸的物质的量的浓度为_____________mol/L。
(3)混合物中Mg和Al的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。
A、②③⑤ B、①④⑦ C、②⑦⑨ D、⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的空间构型是________。
(2)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的化学反应速率为____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的化学反应速率为____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
(2)下图表示在密闭容器中反应:2SO2+O2 ![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是 ;b-c过程中改变的条件可能是 ;若在c处增大压强时,反应速度变化和达平衡情况画在c-d处,并标出V正和V逆。
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是 ;b-c过程中改变的条件可能是 ;若在c处增大压强时,反应速度变化和达平衡情况画在c-d处,并标出V正和V逆。

(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡后,容器内温度将____________[填“升高”、“降低”或“不变”(容器不与外界进行热交换)];达新平衡时,容器内混合气体的平均相对分子质量与原平衡相比_____________(填“增大”、“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:X+3Y![]() 2Z(该反应放热),其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
2Z(该反应放热),其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
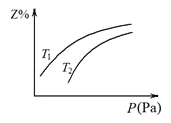
A.T1大于T2
B.Y一定呈气态
C.升高温度,该反应的化学平衡常数增大
D.当n(X):n(Y):n(Z)=1:3:2时,反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式 _。
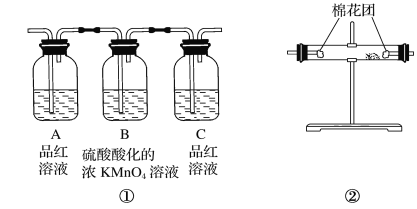
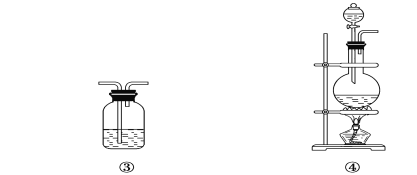
(2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是________→________→________→________(填装置的编号)。
(3)怎样检查整套装置的气密性
(4)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是________,B瓶溶液的作用是________,C瓶溶液的作用是________。
(5)装置②中所加的固体药品是________,可验证的产物是________。
(6)装置③中所盛溶液是________,可验证的产物是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。

NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
回答下列问题:
根据实验目的,接口连接的顺序为
1→ → →2→3 →6→7→ → → 。
(2)C装置作用是 。
(3)B装置中发生反应的化学方程式为 ,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com