
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
分析 A.CS2的结构与CO2相似;
B.根据价层电子对数=成键电子数+孤电子数判断;
C.根据价层电子对数=成键电子数+孤电子数判断;
D.根据价层电子对数=成键电子数+孤电子数判断.
解答 解:A.CS2的结构与CO2相似,其结构为S=C=S,属于直线形分子,故A错误;
B.ClO3-中Cl原子的价层电子对数=3+$\frac{1}{2}$(7+1-3×2)=4,含有一个孤电子对,所以为三角锥形,故B错误;
C.SF6中S原子的价层电子对数=6+$\frac{1}{2}$(6-6×1)=6,则S原子为sp3d2杂化,故C错误;
D.SiF4中Si原子的价层电子对数=4+$\frac{1}{2}$(4-4×1)=4,SO32-中S原子的价层电子对数=3+$\frac{1}{2}$(6+2-2×3)=4,则SiF4和SO32-的中心原子均为sp3杂化,故D正确.
故选D.
点评 本题考查了杂化类型的判断、分子构型的判断等,题目难度不大,注意把握价层电子对数的计算方法.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
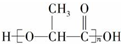 可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )| A. | 合成该材料的单体为 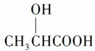 | |
| B. | 该合成材料的单体在氢氧化钠溶液作用下可形成环酯 | |
| C. | 合成该材料的方式与聚苯乙烯不同 | |
| D. | 该材料在一定条件下可发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?CO32-+H3O+ | B. | H2O+H2O?H3O++OH- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 预期现象和结论 |
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,则说明假设1成立,否则假设1不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

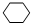
 +Br2→
+Br2→ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$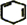 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1 mol石墨比1 mol金刚石的总能量高 | |
| D. | 1 mol石墨与1 mol金刚石的总能量一样高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com