
| ʵ����� | 1 | 2 | 3 |
| ����ʧ���������� | 19.9% | 20.1% | 20.0% |
���� �������������Һ�м��백ˮ������ҺPHֵ2-3Ŀ�������������������ˡ�ϴ�ӡ�����õ�FePO4•xH2O�����������Ǻ��������ĥ���������������װ���и������յõ�LiFePO4��
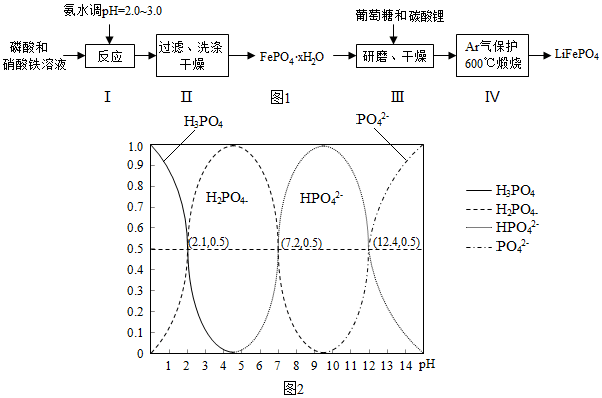
��1��pH��3.0��������������������
��2����������մ����������ӡ�笠����Ӻ������ӵȣ�
��3��ͼ���й���ʧ������������ƽ��ֵ=$\frac{19.9%+20.1%+20.0%}{3}$=20.0%����ϻ�ѧʽ���㣻
��4������III����ĥ�������dz�ֻ����������Ӵ������
��5���ڲ���IV��������LiFePO4��CO2��H2O��д����ѧ����ʽ��ƽ���ϵ����غ���㣻
��6��H3PO4����Ԫ�ᣬ��PO42-��һ��ˮ������ӷ���ʽΪ��PO43-+H2O?HPO42-+OH-���ݴ�д��ˮ�ⳣ��K1�ı���ʽ�����ͼ�����K1��
��� �⣺�������������Һ�м��백ˮ������ҺPHֵ2-3Ŀ�������������������ˡ�ϴ�ӡ�����õ�FePO4•xH2O�����������Ǻ��������ĥ���������������װ���и������յõ�LiFePO4��
��1������I��pH�Ŀ����ǹؼ������pH��1.9��Fe3+��������ȫ��Ӱ����������pH��3.0������ܴ��ڵ������ǣ�����Fe��OH��3���ʣ�Ӱ���������Ĵ��ȣ�
�ʴ�Ϊ������Fe��OH��3���ʣ�Ӱ���������Ĵ��ȣ�
��2������II�У�ϴ����Ϊ�˳�ȥFePO4•xH2O���渽�ŵ�NO3-��NH4+��H+��
�ʴ�Ϊ��NO3-��NH4+��H+��
��3��ͼ���й���ʧ������������ƽ��ֵ=$\frac{19.9%+20.1%+20.0%}{3}$=20.0%��$\frac{18x}{151+18x}$��100%=20%��
x=2.1��
�ʴ�Ϊ��2.1��
��4������III����ĥ������ʹ��Ӧ���Ͼ��ȣ�����Ӧ���ʣ���߷�Ӧ���ʣ�
�ʴ�Ϊ��ʹ��Ӧ���Ͼ��ȣ�����Ӧ���ʣ���߷�Ӧ���ʣ�
��5���ڲ���IV��������LiFePO4��CO2��H2O����Ӧ�Ļ�ѧ����ʽΪ��24FePO4+C6H12O6+12Li2CO3=24LiFePO4+18CO2+6H2O�����������뻹ԭ�������ʵ���֮��Ϊ24��1��
�ʴ�Ϊ��24��1��
��6��H3PO4����Ԫ�ᣬ��PO42-��һ��ˮ������ӷ���ʽΪ��PO43-+H2O?HPO42-+OH-��ˮ�ⳣ��K1�ı���ʽ=$\frac{c��O{H}^{-}��c��HP{{O}_{4}}^{2-}��}{c��P{{O}_{4}}^{3-}��}$��ͼ���п�֪c��PO43-��=c��HPO42-��ʱ��PH=12.4����c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-12.4}}$=10-1.6mol/L����ѡB��
�ʴ�Ϊ��$\frac{c��O{H}^{-}��c��HP{{O}_{4}}^{2-}��}{c��P{{O}_{4}}^{3-}��}$��B��
���� ���⿼�������ʷ����ᴿ���������ʡ����ӷ����������жϡ�ƽ�ⳣ�������֪ʶ�㣬���ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������KMnO4��Һ������ϩ��CH2=CH-CH3 | |
| B�� | ����м����ˮ����������屽 | |
| C�� | ���������Ƿ�ˮ�⣺ȡ1mL 20%��������Һ����3��5��ϡ���ᣮˮԡ����5min��ȡ������Һ���ټ����������Ʊ���Cu��OH��2������3��5 min���۲�ʵ������ | |
| D�� | ��ͭ˿�ھƾ����ϼ��Ⱥ�����������ˮ�Ҵ��У�ͭ˿�ָ���ԭ���ĺ�ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D | |
| ��Ӧ װ�û� ͼ�� |  |  |  |  |
| ʵ���� ���ͼ ����Ϣ | ��Ӧ��ʼ ����Ͳ�� �������ƶ� | ��Ӧ������ ���������� �������� | ��Ӧ��ʼ�� �״�Һ��� ���Ҵ�Һ�� | �¶ȼƵ� ˮ������ ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=7����Һ��Fe3+��NH4+��Cl-��NO3- | |
| B�� | ˮ�������c��H+��=$\sqrt{{K}_{w}}$����Һ�У�Na+��SO42-��CO32-��K+ | |
| C�� | ��ˮ�������c��OH-��=1.0��10-2 mol•L-1����Һ��Cl-��CH3COO-��K+��[Al��OH��4]- | |
| D�� | $\frac{[O{H}^{-}]}{[{H}^{+}]}$=1012����Һ�У�NH4+��Al3+��NO3-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£���100mL 0.01mol/L HA��Һ����μ���0.02mol/L MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������仯���Բ��ƣ�������˵���У�����ȷ���ǣ�������
�����£���100mL 0.01mol/L HA��Һ����μ���0.02mol/L MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������仯���Բ��ƣ�������˵���У�����ȷ���ǣ�������| A�� | HAΪһԪǿ�� | |
| B�� | MOH ΪһԪ���� | |
| C�� | N��ˮ�ĵ���̶�С��K��ˮ�ĵ���̶� | |
| D�� | ��K���Ӧ��Һ��c��MOH��+c��M+��=2C��A_�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢ� | C�� | �ڢۢ� | D�� | �ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�����ڷ�������ԭ��Ӧ | |
| B�� | ��Ӧ����ˮ�ⷴӦ | |
| C�� | ��Ӧ���ж��������������� | |
| D�� | ��Ӧ�ݱ����˽���þ��ԭ�ԱȽ�����ǿ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com