
| A. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| B. | Z元素在反应③中被还原,在反应①中被氧化 | |
| C. | Z2可以置换出X2+溶液中的X | |
| D. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
分析 氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则16H++10Z-+2XO4-═2X2++5Z2↑+8H2O中氧化性为XO4->Z2,2A2++B2═2A3++2B-中氧化性为B2>A3+,2B-+Z2═B2+2Z-中氧化性为Z2>B2,以此来解答.
解答 解:A.由上述分析可知,氧化性Z2>A3+,则反应Z2+2A 2+═2A3++2Z-能发生,故A正确;
B.Z元素在①中化合价升高,被氧化,而在③中元素的化合价降低,被还原,故B正确;
C.由电子、电荷守恒,可知①的;离子方程式为16H++10Z-+2XO4-═2X2++5Z2+8H2O,所以Z2不可以置换出X2+溶液中的X,故C错误;
D.由上述分析可知,氧化性由强到弱的顺序是XO4-、Z2、B2、A3+,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化性的比较方法为解答的关键,侧重分析与应用能力的考查,注意氧化性、还原性的比较方法及守恒法应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗6molPb] | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D | Pb电极反应质量不变 | Pb电极反应质量不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能用分液漏斗分离碘和四氯化碳的混合物 | |
| B. | 蒸发操作时,应使混合物中的水份完全蒸干后,才能停止加热 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯中 | |
| D. | 实验室取用液体药品做实验时,如没有说明用量,一般取1---2mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
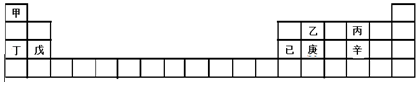
| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的油脂都不能使溴水褪色 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 淀粉可以发生水解反应 | |
| D. | 食用纤维素、淀粉、蛋白质、植物油都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈 | |
| B. | 标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移电子数为2mol | |
| C. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com