
| A. | 达到化学平衡状态时,4v正(O2)=5V逆(NO) | |
| B. | 化学反应速率的关系为2V正(NH3)=3V正(H2O) | |
| C. | 达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到化学平衡状态 |
分析 A、达到化学平衡时,化学反应速率是相等的,且反应速率之比等于方程式的系数之比;
B、速率之比等于对应物质的化学计量数之比;
C、若增加容器体积,相当于减小压强,正逆反应速率都减小;
D、达到化学平衡时,化学反应的正逆反应速率是相等的.
解答 解:A、4v正(O2)=5v逆(NO)能证明化学反应的正逆反应速率是相等的,达到了化学平衡状态,故A正确;
B、速率之比等于对应物质的化学计量数之比,所以化学反应速率的关系为3V正(NH3)=2V正(H2O),故B错误;
C、若增加容器体积,相当于减小压强,正逆反应速率都减小,故C错误;
D、单位时间内生成x mol NO,同时消耗x mol NH3,则不能说明化学反应的正逆反应速率是相等的,只表示了正反应方向,故D错误;
故选A.
点评 本题考查化学平衡状态的判断、化学平衡移动的方向以及影响因素是现在考查的热点,注意知识的归纳和整理,难度不大.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | V(A)=2.0mol/(L•s) | B. | V(B)=1.2mol/(L•s) | C. | V(C)=3.2mol/(L•s) | D. | V(D)=4.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.NaCl溶液在电流作用下电离成Na-与Cl-
B.溶于水后能电离出H+的化合物都是酸
C.氯化氢溶于水能导电,但液态氯化氢不能导电
D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A.△H4 = 2/3(△H1 +△H2 - 3△H3) B.△H4 = 2/3(3△H3 -△H1 -△H2)
C.△H4 = 3/2(△H1 +△H2 - 3△H3)  D.△H4 = 3/2(△H1 -△H2 - 3△H3)
D.△H4 = 3/2(△H1 -△H2 - 3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
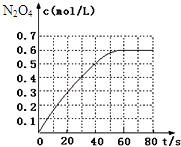 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )| A. | v(正)>v(逆) | B. | v(正)<v(逆) | ||
| C. | v(正)=v(逆) | D. | v(正)、v(逆)大小关系不确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Ba2+、Mg2+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
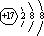 .乙的单质的电子式为
.乙的单质的电子式为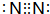 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com