
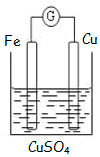
 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓. 分析 牺牲阳极的阴极保护法中指的是:原电池的负极金属被腐蚀,正极金属被保护,根据原电池的工作原理以及亚铁离子的检验知识来回答.
解答 解:牺牲阳极的阴极保护法中指的是:原电池的负极金属被腐蚀,正极金属被保护,此装置中Zn电极是负极,该极上的电极反应为Zn-2e-=Zn2+;将锌改为Pt,则金属铁是负极,发生电极反应:Fe-2e-=Fe2+;滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,产生蓝色沉淀;
故答案为:Zn-2e-=Zn2+;产生蓝色沉淀;3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
点评 本题考查了原电池原理的应用、电极方程式的书写、离子的检验,题目难度不大,明确原电池正负极的判断方法和电极方程式的书写方法以及亚铁离子的检验方法即可解答.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
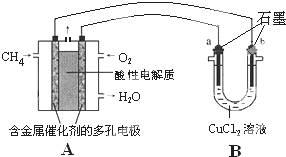 (3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | 19.8℃ | △H1 |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | 19.3℃ | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 有弱酸性,与Na2CO3、NaHCO3溶液均能反应 | |
| B. | 在一定条件下,1 mol该物质最多能与3 mol NaOH完全反应 | |
| C. | 在一定条件下,该物质可以发生取代、加成、水解、消去反应 | |
| D. | 该有机物分子中所有碳原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com