
【题目】300℃时,将2molA和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
(1)300℃时,该反应的平衡常数表达式为:K=___。已知K300℃<K350℃,则ΔH__0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为___,D的平均反应速率为___。
(3)若温度不变,缩小容器容积,则A的转化率___(填“增大”“减小”或“不变”),原因是___。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B__mol。
【答案】![]() > 0.8mol/L 0.2mol/(L·min) 不变 反应前后气体体积不变,压强对平衡无影响
> 0.8mol/L 0.2mol/(L·min) 不变 反应前后气体体积不变,压强对平衡无影响 ![]()
【解析】
根据三段式求出各组分的物质的量的变化量、平衡时各组分的物质的量,
(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;根据平衡常数的变化可判断温度对平衡移动的影响;
(2)根据方程式计算C的物质的量可计算C的浓度,根据![]() 计算反应速率;
计算反应速率;
(3)该反应反应前后气体体积不变,结合方程式的特点判断平衡的影响结果;
(4)为等效平衡,反应前后气体体积不变,按化学计量数转化为反成物,满足n(A):n(B)=1:1即可。
对于反应: 3A(g)+B(g) ![]() 2C(g)+2D(g),
2C(g)+2D(g),
开始(mol): 2 2 0 0
变化(mol): 1.2 0.4 0.8 0.8
平衡(mol): 0.8 1.6 0.8 0.8
(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=![]() ;K300℃<K350℃说明升高温度平衡向正反应方向移动,则正反应放热,△H>0。
;K300℃<K350℃说明升高温度平衡向正反应方向移动,则正反应放热,△H>0。
故答案为: K=![]() ;>
;>
(2)由上述计算可知,平衡时B的物质的量为1.6mol,所以B的平衡浓度为c(B)= ![]() =0.8mol/L,
=0.8mol/L,
平衡时D的物质的量为0.8mol,所以用D表示的平均反应速率为 ,
,
故答案为:0.8mol/L;0.2mol/(L![]() min);
min);
(3)由方程式可知,气体的化学计量数之和前后相等,则反应前后气体体积不变,压强对平衡无影响,缩小容器容积,则A的转化率不变;
故答案为:不变;反应前后气体体积不变,压强对平衡无影响;
(4)为等效平衡,应前后气体体积不变,按化学计量数转化到左边,满足n(A):n(B)=1:1即可。
根据3A(g)+B(g) ![]() 2C(g)+2D(g)可知C和D各
2C(g)+2D(g)可知C和D各![]() mol,转化到左边可得A.为2mol,B为
mol,转化到左边可得A.为2mol,B为![]() mol,令B的物质的量为n mol,则:
mol,令B的物质的量为n mol,则: ![]() 2mol:2mol,解得n=
2mol:2mol,解得n=![]() mol。
mol。
故答案为: ![]() mol;
mol;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的5种短周期主族元素;原子半径按D、E、B、C、A顺序依次减小,B和E是同主族元素。
(1)下列推断正确的是________。
a A、B、E不可能在同一主族
b A、B、C可能在同一周期
c C的最高价氧化物的水化物可能显碱性
d C和D的单质可能生成离子化合物
(2)若A与D同主族,B属非金属元素,它的一种单质是电的良导体,C原子的最外层电子数比A与B的最外层电子数总和还多1。则①A与C元素按原子个数比1:1形成的化合物F的电子式为______;F属于__________分子(填“极性”或“非极性”)
②由A、B、C、D四元素按原子个数比1:1:3:1形成的化合物为_________,它与A、C、D形成的化合物在水溶液中反应的离子方程式为_______;
③E在周期表中的位置 ______ C和E形成的化合物属于_____晶体
④由A、B、C元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是____(填化学式)。
⑤B、C、E氢化物的沸点由高到低为__________,试说明原因 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1MgSO4和0.05mol·L-1Al2(SO4)3溶液进行实验:①各取25mL,分别滴加0.5mol·L-1NaOH溶液,测得溶液pH与V(NaOH)的关系如图1;②将两种溶液等体积混合后,取出25mL,逐滴加入上述NaOH溶液,观察现象。下述正确的是 ( )
图1  图2
图2
A.图1中的曲线II表示MgSO4与NaOH反应的关系
B.根据图1可得Ksp[Al(OH)3]的值大于1.0×10-32
C.实验②中Al(OH)3完全溶解前,溶液中c(Mg2+)/c(Al3+)逐渐变大
D.图2可以表示实验②中n(沉淀)与V(NaOH)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)![]() CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
t/s | 0 | 500 | 1000 |
c(H2)/ mol.L-1 | 5.00 | 3.52 | 2.48 |
c(CO)/ mol.L-1 | 2.50 |
(1)在500s内用H2表示的化学反应速率是________________。
(2)在1000s内用CO表示的化学反应速率是________________,1000s时CO的转化率是________。
(3)在500s时生成的甲醇的浓度是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质隐形眼镜材料W、树脂X的合成路线如下:
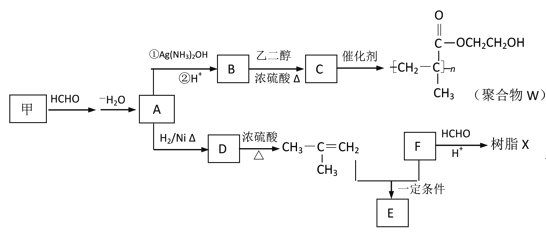
已知:
(1)A 中含有的官能团名称是___________。
(2)甲的结构简式是___________。
(3)B → C反应的化学方程式是___________。
(4)B有多种同分异构体。属于酯且含有碳碳双键的同分异构体共有__________种(不考虑顺反异构,下同),写出其中能发生银镜反应,且含有甲基的所有同分异构体的结构简式是__________。
(5)已知F的相对分子质量为110,分子中碳原子、氢原子数都是氧原子数的3倍,苯环上的氢原子化学环境都相同。则F还能发生的反应是(填序号)___________。
a 加成反应 b 氧化反应 c 加聚反应 d 分解反应
(6)写出树脂X可能的结构简式(写出一种即可)_________。
(7)E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种。生成E的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的ΔH______0(填“<”“>”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为________。
(3)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com