
| 0.18g |
| 18g/mol |
| 0.224L |
| 22.4L/mol |
| 0.16g |
| 16g/mol |
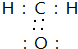 ,
,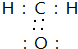 ;
;

科目:高中化学 来源: 题型:
| A、C2H5OH C3H7OH |
| B、C3H7OH CH3OH |
| C、CH3OH C2H5OH |
| D、C3H7OH C4H9OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
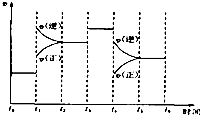 已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平均反应速率:v(A)=v(C) |
| B、其它条件不变,升温,气体总的物质的量增加 |
| C、A的平衡浓度为0.4mol/L |
| D、A与B的平衡浓度之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 香豆素又称双呋精环,英文名称coumanin,天然存在于黑香豆,香蛇鞭菊、兰花等植物中,是一种重要的香料,还可用作抗凝血剂.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示.下列有关叙述错误的是( )
香豆素又称双呋精环,英文名称coumanin,天然存在于黑香豆,香蛇鞭菊、兰花等植物中,是一种重要的香料,还可用作抗凝血剂.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示.下列有关叙述错误的是( )| A、分子中含有不同的含氧宫能团 |
| B、能发生水解反应,但不能使酸性KMn2O4溶液褪色 |
| C、能与H2发生加成反应 |
| D、1mol香豆素-4最多能与3molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去BaSO4中少量的BaCO3 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5mol?L-1的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中少量的NaI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2可用于呼吸面具中氧气的来源 |
| B、Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物 |
| C、Na2CO3可用于制玻璃、肥皂、造纸、纺织等工业,而NaHCO3可用于治胃酸过多,制发酵粉等 |
| D、NaCl的性质稳定,可用作调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com