在(NH4)2SO4中加入足量的NaOH溶液,加热,充分反应后产生4.48L气体(标准状况),求(NH4)2SO4的质量.如将所得氨气完全溶解在1L水中(溶解前后溶液体积变化忽略不计),求所得氨水溶液的质量分数和物质的量浓度______.
【答案】
分析:根据n=
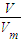
计算生成氨气的物质的量,根据氮元素守恒可知n[(NH
4)
2SO
4]=

n(NH
3),再根据m=nM计算(NH
4)
2SO
4的质量;
根据m=nM计算氨气的质量,根据m=ρV计算水的质量,根据ω=
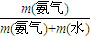
×100%计算所得氨水的质量分数;
根据c=
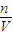
计算所得氨水的物质的量浓度.
解答:解:(1)(NH
4)
2SO
4与NaOH溶液反应生成氨气为4.48L,则氨气的物质的量=
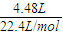
=0.2mol,
根据氮元素守恒可知n[(NH
4)
2SO
4]=

n(NH
3)=

×0.2mol=0.1mol,
故(NH
4)
2SO
4的质量=0.1mol×132g/mol=13.2g,
答:(NH
4)
2SO
4的质量为13.2g.
(2)ω(氨气)=
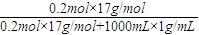
×100%=3.3%,
c(氨水)=
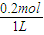
=0.2mol/L,
故答案为:3.3%;0.2mol/L.
点评:本题考查常用根据方程式的有关计算、物质的量浓度计算、质量分数计算等,比较基础,注意对基础知识的理解掌握.

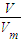 计算生成氨气的物质的量,根据氮元素守恒可知n[(NH4)2SO4]=
计算生成氨气的物质的量,根据氮元素守恒可知n[(NH4)2SO4]= n(NH3),再根据m=nM计算(NH4)2SO4的质量;
n(NH3),再根据m=nM计算(NH4)2SO4的质量;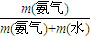 ×100%计算所得氨水的质量分数;
×100%计算所得氨水的质量分数;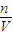 计算所得氨水的物质的量浓度.
计算所得氨水的物质的量浓度.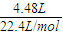 =0.2mol,
=0.2mol, n(NH3)=
n(NH3)= ×0.2mol=0.1mol,
×0.2mol=0.1mol,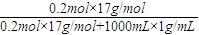 ×100%=3.3%,
×100%=3.3%,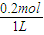 =0.2mol/L,
=0.2mol/L,

 黄冈创优卷系列答案
黄冈创优卷系列答案