
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:阅读理解
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
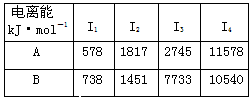
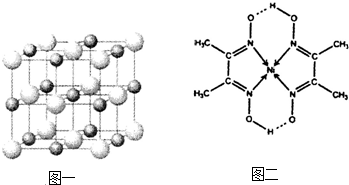 (3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图一所示),其中3种离子晶体的晶格能数据如下表:
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图一所示),其中3种离子晶体的晶格能数据如下表:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
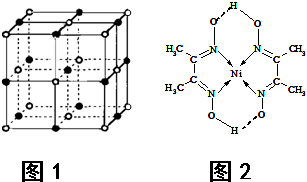 (2013?渭南二模)决定物质性质的重要因素是物质结构.请回答下列问题.
(2013?渭南二模)决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
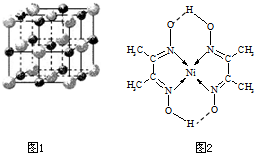 (2011?姜堰市二模)决定物质性质的重要因素是物质结构.请回答下列问题.
(2011?姜堰市二模)决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A的化合价 B的化合价(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如上图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
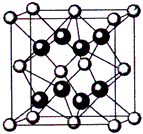
(4)某配合物的分子结构如上图所示,则N原子的杂化方式为 ;基态Ni原子的电子排布式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期10月份月考化学试卷 题型:填空题
(12分)决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
则,A的化合价 ▲ B的化合价(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),
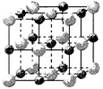
其中3种离子晶体的晶格能数据如下表:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: ▲ ,原因是: ▲ 。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)某配合物的分子结构如右图所示,

则N原子的杂化方式为 ▲ ;基态Ni原子的电子排布式 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com