
 我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )
我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )| A. | 电池工作时,电子的流向:锂电极→导线→碳电极 | |
| B. | 水既是氧化剂又是溶剂,有机电解质可用水溶液代替 | |
| C. | 电池总反应为2Li+2H2O=2LiOH+H2 | |
| D. | 该装置不仅可提供电能,还可得到清洁燃料氢气 |
分析 因锂与水反应,则形成原电池时锂为负极,碳为正极,且负极不能与水接触,负极反应为Li-e-=Li+,正极反应为2H2O+2e-=H2↑+2OH-,结合电极方程式解答该题.
解答 解:A.锂为负极,为原电池的负极,碳为正极,则电子的流向:锂电极→导线→碳电极,故A正确;
B.由于金属Li可以和水之间反应生成氢氧化锂和氢气,但是和有机电解质不反应,所以有机电解质不可用水溶液代替,故B错误;
C.负极反应为Li-e-=Li+,正极反应为2H2O+2e-=H2↑+2OH-,电池总反应为2Li+2H2O=2LiOH+H2,故C正确;
D.反应可提供电能,且生成氢气,可用作清洁燃料,故D正确.
故选B.
点评 本题考查新型电池,为高频考点,侧重于学生的分析能力的考查,题目难度不大,解答本题的关键是根据物质的性质判断电极反应,并能书写有关反应的离子方程式.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 能自发进行的反应一定能迅速发生 | |
| B. | 反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为判断反应能否自发进行的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═Cl-+ClO-+2H+ | |
| B. | 金属钠加入稀硫酸中:Na+2H+═Na++H2↑ | |
| C. | 明矾溶液中加入足量Ba(OH)2溶液:SO42-+Al3++Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 向含有稀盐酸的氯化亚铁溶液中通入氧气:4Fe2++O2+4H+═4 Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加3%Na2S2O3/mL | 加1:5的H2SO4/滴 | 温度/℃ | |
| A | 5 | 25 | 25 |
| B | 5 | 15 | 35 |
| C | 5 | 25 | 45 |
| D | 5 | 15 | 45 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
硝酸铵 | 过氧化钠 高锰酸钾 氯酸钾 |
钠 钙 过氧化氢 | 氧化钠 |
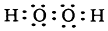
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
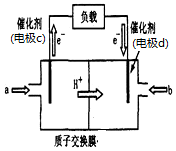 火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.
火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:
本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaCl固体置于托盘天平右盘称量:左盘砝码(8g)和游码(0.6g)读数的和为8.6g | |
| B. | 容量瓶上标有刻度线、温度和浓度,使用前要事先检查是否漏水 | |
| C. | 配制一定物质的量浓度的溶液用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、容量瓶、胶头滴管 | |
| D. | 配制1L0.2mol/L的H2SO4溶液,定容时仰视刻度线操作,则配出浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中的能量变化除了热能外,还可以是光能、电能等 | |
| B. | 放热反应的△H<0 | |
| C. | 需要加热才能发生反应一定是吸热反应 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com