
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | A | B | ||||||
| 3 | C | D | E | F | H | |||
| 4 | G | R |
分析 (1)由元素在周期表的位置确定元素,稀有气体的性质最不活泼;
(2)E元素的最高价氧化物对应的水化物为氢氧化铝,与氢氧化钠溶液反应生成偏铝酸钠和水;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小;
(4)B元素最常见的氢化物为水,与K反应生成KOH和氢气;
(5)R元素跟C元素形成的化合物为NaBr,钠的焰色反应为黄色;
(6)F和R元素的核电荷数分别为17、35.
解答 解:(1)由元素在周期表的位置可知,A为C、B为O、C为Na、D为Mg、E为Al,用中文名称表示元素F为 氯,G为钾,H为氩,R为溴,其中化学性质最不活泼的元素为Ar,其质子数是18,
故答案为:C;O;Na;Mg;Al;氯; 钾;氩; 溴;18;
(2)E元素的最高价氧化物对应的水化物为氢氧化铝,与氢氧化钠溶液反应生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小,则D、E、A三种元素按原子半径由大到小的顺序排列的是Mg>Al>C,
故答案为:Mg>Al>C;
(4)B元素最常见的氢化物的化学式是H2O,该氢化物在常温下跟G发生反应的化学方程式是2K+2H2O=2KOH+H2↑,溶液溶质为KOH,所得溶液的pH>7,
故答案为:H2O;2K+2H2O=2KOH+H2↑;>;
(5)R元素跟C元素形成的化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色,故答案为:NaBr;黄;
(6)F和R元素的核电荷数分别为17、35,二者之差为35-17=18,故答案为:18.
点评 本题考查位置、结构、性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意氢氧化铝为两性氧化物,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国科学院长春应用化学研究所在甲烷燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲烷燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲烷燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲烷燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )2]的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,遇强酸解离为阿司匹林(
)2]的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,遇强酸解离为阿司匹林( ,M=180)和Cu2+;
,M=180)和Cu2+;| 阿司匹林溶解质量 | 阿司匹林铜的溶解质量 | |
| 氯仿 | 0.4g | 不溶 |
| 无水乙醇 | 0.9g | 不溶 |
| 蒸馏水 | 不溶 | 不溶 |
| 实验编号 | 阿司匹林:无水硫酸铜/物质的量之比 | 产率% | ||
| X1 | X2 | 平均值 | ||
| 1 | 1:1 | 76.6 | 78.1 | 77.4 |
| 2 | 2:1 | 78.6 | 75.1 | 76.8 |
| 3 | 3:1 | 93.9 | 95.9 | 94.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 |
| 向硬水中加入①(填序数),直到不再产生沉淀为止. |
| 继续向溶液中加入③(填序数),直到不再产生沉淀为止. |
| 将上述混合物过滤(填操作) |
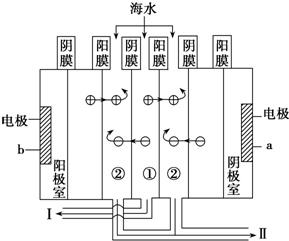
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液240mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液240mL:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | NH3+HCl═NH4Cl | ||
| C. | 2 NaOH+SO2═Na2SO3+H2O | D. | AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com