
【题目】设 NA 表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 标准状况下,22.4L CCl4 含有的原子数为 5NA
B. 1.8g 的 NH4+中含有的电子数为 NA
C. 常温常压下,32 g O2 和 O3 的混合气体中所含原子数为 1.5 NA
D. 2.3g Na 在 O2中燃烧,失去电子数目为 0.2NA
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列关于0.2 mol/L Ba(NO3)2溶液的叙述不正确的是( )
A. 2 L溶液中阴阳离子总数大约为1.2NA
B. 500 mL溶液中NO![]() 浓度为0.2 mol/L
浓度为0.2 mol/L
C. 500 mL溶液中Ba2+浓度为0.2 mol/L
D. 500 mL溶液中NO![]() 物质的量为0.2 mol
物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组在“探究物质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致。则溶液呈黄色是含________(填化学式或离子符号,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
A.酚酞试液 B.四氯化碳 C.无水酒精 D.硫氰化钾溶液
请写出丙同学的一种方案,选用的试剂及实验现象填在下表空格中。(试剂填序号)
选用试剂 | 实验现象 | |
方案 | ①__________ | ②__________ |
(4)应用与拓展
①在少量FeBr2溶液中通入足量Cl2,反应的离子方程式为 __________________。
②在100 mLFeBr2溶液中通入7.84 LCl2(标准状况),溶液中有2/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为______________。
③写出Fe(NO3)3溶液与少量HI溶液反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种理想的绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。
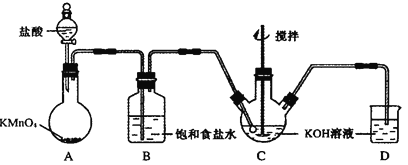
查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的用途是_________________。
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是___________。
(3)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式____________________________________________;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是________________________________________。
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质。一种提纯方案为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式)______________、___________,过滤时不用普通漏斗而采用砂芯漏斗的原因是_____________________。
②晶体用乙醇洗涤的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A. 该合金中铜与镁的物质的量之比是2∶1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图I所示,甲、乙之间的隔板K和活塞F都可以左右移动,F受压力恒定。甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )
2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )
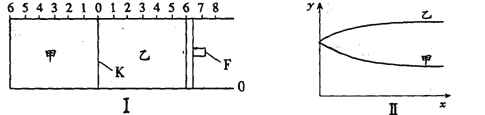
A. 达到平衡时隔板K最终停留在0刻度左侧的2到4之间
B. 若达到平衡时隔板K最终停留在左侧1处,则乙中C的转化率小于50%
C. 如图II所示若x轴表示时间,则y轴可表示甲、乙两容器中气体的总物质的量或A的物质的量
D. 若达到平衡时隔板K最终停留在左侧靠近2处,则乙中F最终停留在右侧刻度大于4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中除含有Ca2+、Mg2+、SO![]() 等可溶性杂质外,还含有泥砂等不溶性杂质。
等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO![]() 的方法是______________________________________。
的方法是______________________________________。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。滴加Na2CO3溶液时发生反应的离子方程式为__________________。
(3)用四氯化碳提取出溴水中的溴的方法叫做___________,将溴的四氯化碳溶液和水分离开的操作叫做___________,下列是进行该操作的步骤,正确的顺序是_______________。
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接收溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的俗称、成分及用途对应正确的是( )
A | B | C | D | |
俗称 | 漂粉精 | 小苏打 | 钡餐 | 铁红 |
成分 | NaClO | Na2CO3 | BaCO3 | Fe2O3 |
用途 | 消毒剂 | 发酵粉 | X光片 | 涂料 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com