
| A、②③④① | B、④①②③ |
| C、①④②③ | D、③②①④ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
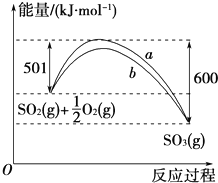 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 molCl2参加反应转移电子数一定为2NA |
| B、标准状况下,2.24 L乙醇分子所含的C-H键数为 0.5NA |
| C、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| D、标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时仰视刻度线 |
| B、未等溶液冷却至室温就进行定容 |
| C、转移溶液后,未洗涤烧杯和玻璃棒 |
| D、溶液在引流时溅出容器外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相对分子质量相同,必定同一种物质或同分异构体 |
| B、乙酸乙酯、油脂与NaOH溶液反应均有乙醇生成 |
| C、用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯 |
| D、分子式相差一个或若干个“CH2”的有机物必定属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往CH3COOH溶液中加水,c(OH-)和c(H+)均增大 |
| B、物质的量浓度均为0.1mol?1-1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)>(CH3COO-) |
| C、某浓度的氯化铵溶液中存在c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D、在pH=4的氯化铵溶液中c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com