
【题目】在反应aFeCl2+bKNO3+cHCl=- dFeCl3+eKCl+fX+gH2O中,其中a,b,c,d,e,f,g均为相应的物质系数,若b=l.d=3,则生成物X的分子式为
A. NO2 B. NO C. N2O D. NH4Cl
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应转化关系(未配平)肯定不正确的是( )
A. S+NaOH→Na2SO3+K2S+H2O B. FeO+HNO3→Fe(NO3)3+H2O
C. Cu2O+H2SO4→CuSO4+Cu+H2O D. NH4NO3→N2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3 , 以及少量Fe、Si的化合物.可以用孔雀石为原料制备胆矾(CuSO45H2O),步骤如图: 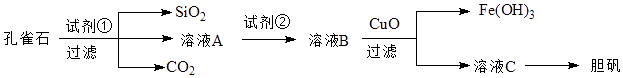
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式 . 过滤所需要的玻璃仪器有
(2)实验室检验Fe3+的常用方法是 .
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+ , 上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+ , 从而形成溶液B,则试剂②能否用氯水(填“能”或“不能”,若“不能”,请解释原因).
(4)由溶液C获得胆矾,需要经过、、过滤等操作.
(5)取25.00mL溶液A,用1.000×10﹣2mol/LKMnO4标准溶液滴定.反应离子方程式为:5Fe2++MnO4﹣+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氧化钠溶液、②铜片、③碳酸钙、④蔗糖、⑤熔融的NaCl、⑥SO2气体、⑦碳酸氢钠、⑧盐酸
(1)能导电且属于电解质的是___________。(填编号)
(2)写出碳酸钙的电离方程式____________________________________。
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式____________________________________。
(4)向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。

则
①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为_________(写化学式)。
②盐酸的浓度为________________________。
③B点时,产生的气体在标准状况下的体积为_________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式(有条件的注明条件)并标明反应类型 ①向苯酚溶液中加入足量浓溴水的反应: ,
②乙醛的银镜反应 ,
③写出丙醛与新制Cu(OH)2悬浊液反应 ,
④实验室制乙烯的反应 , .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备四氯化硅液体的装置。已知:四氯化硅熔点为-70℃,沸点57.6℃,遇水极易反应。

请回答下列问题。
(1)写出装置A中发生反应的离子方程式_______________________________。
(2)8.7 g MnO2 和足量的浓盐酸反应,其中被氧化的HCl的物质的量为____________mol。
(3)装置B中盛放的试剂是__________________;
(4)g管的作用是_________________。
(5)装置E中冰水的作用是_________________。
(6)干燥管F中碱石灰的作用是______________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为: 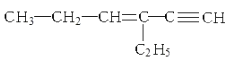 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.1mol该烃完全燃烧消耗11mol O2
B.与氢气完全加成后的产物中含3个甲基
C.1mol该烃完全加成消耗Br2的物质的量为3mol
D.该烃的核磁共振氢谱有12个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学仰视量筒中液体,读其体积为m mL,倒出少许后俯视读数为n mL,则倒出的液体体积
A.小于(m-n)mLB.大于(m-n)mL
C.等于(m-n)mLD.大于或等于(m-n)mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过方法区分晶体、准晶体和非晶体.
(2)基态Fe原子有个未成对电子,Fe3+的电子排布式为 , 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O,乙醛中碳原子的杂化轨道类型为;1mol乙醛分子中含有的σ键的数目为 , 乙酸的沸点明显高于乙醛,其主要原因是 . Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子.
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 , 列式表示Al单质的密度gcm﹣3(不必计算出结果).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com