
【题目】锂海水电池的反应原理为:2Li+2H2O=2LiOH+H2↑,其示意图如图所示。有关该电池工作时说法错误的是

A.金属锂作正极
B.镍电极上发生还原反应
C.海水作为电解质溶液
D.可将化学能转化为电能
【答案】A
【解析】
锂海水电池的电池反应为2Li+2H2O═2LiOH+H2↑,金属锂做原电池负极失电子发生氧化反应,电极反应:Li-e-=Li+,金属镍做原电池正极,海水中水得到电子发生还原反应生成氢气,电极反应:2H2O+2e-=2OH-+H2↑,电子从负极沿导线流向正极。
A. 锂海水电池的电池反应为2Li+2H2O═2LiOH+H2↑,金属锂做原电池负极失电子发生氧化反应,电极反应:Lie=Li+,故A错误;
B. 金属镍做原电池正极,海水中水得到电子发生还原反应生成氢气,电极反应:2H2O+2e-=2OH-+H2↑,故B正确;
C. 原电池中利用海水做电解质溶液,形成闭合回路,故C正确;
D. 装置为原电池反应,化学能转化为电能,故D正确;
答案选A。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】研究含碳化合物的结构与性质,对生产、科研等具有重要意义
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+计与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。
a.基态锂离子核外能量最高的电子所处能层符号为___________;
b.W中Li+与孤对电子之间的作用属于___________(选填字母标号)
A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+计形成稳定结构。理由是___________。
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶人冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是___________,H-O键键角___________(填“>”“<”或“=”)109°28′
ii.已知:冠醚Z与KMnO4可以发生右图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是___________。
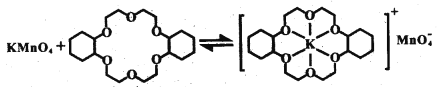
(2)甲烷是重要的清洁能源,其晶体结构如图所示,晶胞参数为anm。
①常温常压下不存在甲烷晶体。从微粒间相互作用的角度解释,其理由是___________;
②甲烷分子的配位数为___________;
③A分子中碳原子的坐标参数为(0,0,0),则B分子的碳原子的坐标参数为___________。
④甲烷晶体的密度为___________(g·cm-3)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学键是物质中原子间强烈的相互作用
B. 化学键是使原子或离子相结合的作用力
C. 一切物质中都存在化学键
D. ⅠA族元素原子与ⅦA族元素原子之间都形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是

A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED灯是一种环保的光源,在相同照明效果下比传统光源节能80%以上。目前市售LED晶片材质基本以砷化镓、磷化铝镓钢(AlGaInP)、氮化铟镓( InGaN)为主,砷化镓的晶胞结构如图。回答下列问题:

(1)砷的基态原子的电子排布式是___________。
(2)磷和砷是同一族的元素,第一电离能:磷___________(填“>”“<”或“=”,下同)砷,它们形成的氢化物的沸点:PH3___________AsH3,原因是______________________。
(3)AsH3是无色、稍有大蒜味的气体。AsH3中砷原子的杂化轨道方式为___________,AsH3的空间结构为___________。
(4)砷元素的常见化合价有+3和+5,它们对应的含氧酸有H3AsO3和H3AsO4两种,其中H3AsO4的酸性比H3AsO3的酸性强,从物质结构与性质的关系来看,H3AsO4的酸性比H3AsO3的酸性强的原因是_________________________________。
(5)此晶胞中所含的砷原子的个数为___________,砷化镓的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物。合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为 ,请回答下列问题:
,请回答下列问题:
(1)G物质中官能团的名称是羧基、___________、___________。
(2)反应A→B的化学方程式为______________________。
(3)上述④⑤变化过程的反应类型分别是___________、___________。
(4)写出满足下列条件的C的同分异构体的结构简式:___________、___________。
I.苯环上只有两种取代基;
Ⅱ.分子中只有4种不同化学环境的氢;
Ⅲ.能与 NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选)。____________
的合成路线流程图(无机试剂任选)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下空:
(1)已知热化学方程式:SO2(g)+1/2O2(g)SO3(g) ΔH=-98.32 kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量______(填字母)。
a.=196.64 kJ b.=98.32 kJ c.<196.64 kJ d.>196.64 kJ
(2)FeS2焙烧产生的SO2可用于制硫酸。其中SO2的空间结构为________;H2SO4中阴离子中心原子杂化类型为__________杂化。

(3)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式____________________________________
②捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3
则a:ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。b:若反应Ⅰ、反应Ⅱ的平衡常数分别为K1、K2,则反应Ⅲ的平衡常数K3=__________(用K1、K2表示)。
(4)元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,CrO42和Cr2O72在溶液中可相互转化。
①离子方程式表示Na2CrO4溶液中的转化反应____________。
②溶液酸性增大,CrO42的平衡转化率______(填“增大“减小”或“不变”)
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH______0 (填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和乙烷比较的说法中错误的是( )
A. 乙烯属于不饱和烃,乙烷属于饱和烃
B. 通常情况下,乙烯的化学性质比乙烷活泼
C. 乙烯能发生加成反应,乙烷能发生取代反应
D. 同质量的乙烯和乙烷完全燃烧,生成二氧化碳的质量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com