
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
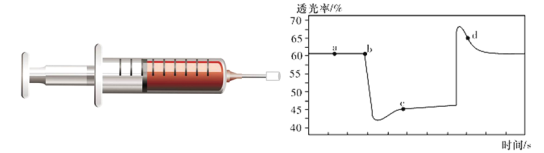
A.b点的操作是拉伸注射器
B.d点:v(正) > v(逆)
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则温度T(c) > T(d)
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.将0.1mol/L的NaOH的温度提高至80℃,溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
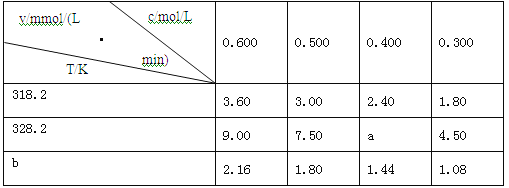
A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应生成一种无氧酸和两种氮的常见氧化物。亚硝酰氯应用广泛,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组同学拟制备原料气NO和Cl2,制备装置如图所示,为制备纯净干燥的气体,补充右表中缺少的药品。
装置Ⅰ | 装置Ⅱ | ||
蒸馏烧瓶中 | A仪器中 | ||
制备纯净的Cl2 | MnO2 | ①______ | ②______ |
制备纯净的NO | Cu | ③______ | ④______ |

(2)乙组同学对甲组同学制取NO的装置略加改良,结合甲组制得的Cl2共同制备NOCl,装置如图所示:
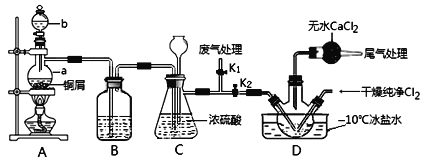
①仪器b的名称为________________。
②组装好实验装置后应先______________,然后依次装入药品。此实验关键操作有两点:一是将Cl2充满D装置的三颈瓶中;二是A中反应开始时要先关闭K2,打开K1,待NO充满装置后再关闭K1,打开K2。这两步操作中充满的目的都是__________________________________________________。
③若C装置中压强过大,可以观察到的现象是_________________________。
④装置D中冰盐水的作用是__________________。
(3)亚硝酰氯(NOCl)纯度的测定:将所得亚硝酰氯(NOCl)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)与水反应的化学方程式为_________________________。
②亚硝酰氯(NOCl)的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭粉与![]() 反应的产物比较复杂,某化学研究小组在实验室中以炭粉与
反应的产物比较复杂,某化学研究小组在实验室中以炭粉与![]() 反应为探究对象,拟通过实验探究反应后的产物,提出如下4种猜想:
反应为探究对象,拟通过实验探究反应后的产物,提出如下4种猜想:
猜想1:反应后产物是![]()
猜想2:反应后产物是![]() 和CO
和CO
猜想3:反应后产物是![]() 和
和![]()
猜想4:反应后产物是![]() 和
和![]()
(1)实验前,小组成员经过讨论认定猜想3不成立,理由是______。
(2)实验过程:已知:湿润的氯化钯试纸遇CO变黑,可用于检验是否有CO生成,针对猜想1、2、4,设计如图所示的实验装置:

![]() 根据上图连接好实验装置,并检查气密性。
根据上图连接好实验装置,并检查气密性。
![]() 将
将![]() 炭粉与
炭粉与![]() 均匀混合装入试管,在靠近试管口处放置一张湿润的氯化钯试纸。
均匀混合装入试管,在靠近试管口处放置一张湿润的氯化钯试纸。
![]() 用酒精灯微微加热试管底部。
用酒精灯微微加热试管底部。
![]() 试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,澄清石灰水未变浑浊。
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,澄清石灰水未变浑浊。
其中装置B的作用是______;由此可推测猜想______不成立。若CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。
(3)结果分析讨论:
试管冷却至室温、称量、测得剩余固体的质量为![]() ,由此可初步确认猜想______是正确的,炭粉与
,由此可初步确认猜想______是正确的,炭粉与![]() 反应的化学方程式为______。请你设计实验验证上述猜想4,完成下表中内容。
反应的化学方程式为______。请你设计实验验证上述猜想4,完成下表中内容。![]() 可供选择的药品有
可供选择的药品有![]() 溶液、酚酞溶液、盐酸等
溶液、酚酞溶液、盐酸等![]()
实验方案 | 预期实验结果和结论 |
____________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。其工业合成原理为:
①2Fe(OH)3+3NaClO+10NaOH=2Na2FeO4+6NaCl+8H2O
②Na2FeO4+2KOH![]() K2FeO4↓+2NaOH
K2FeO4↓+2NaOH
高铁酸钾与水反应生成Fe(OH)3胶体和氧气等。
【1】关于反应①下列说法正确的是
A.Fe(OH)3得到电子B.NaClO失去电子
C.NaClO被还原D.NaOH是氧化剂
【2】反应②属于
A.化合反应B.分解反应C.置换反应D.复分解反应
【3】关于反应②下列说法正确的是
A.减小Na2FeO4浓度能够加快反应速率
B.增大KOH浓度能够加快反应速率
C.升高温度可以减慢反应速率
D.加入足量的KOH可以使Na2FeO4100%转化为K2FeO4
【4】NaClO属于
A.氧化物B.酸C.碱D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用。下图是利用乙酰丙酸(![]() )合成聚芳酯E的路线:
)合成聚芳酯E的路线:
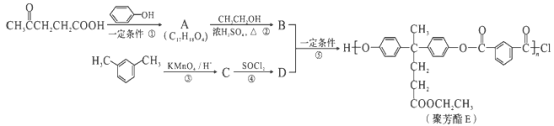
已知:①![]()
②![]() (R、R′表示烃基)
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和_______(填官能团名称)。
(2)D的结构简式为_______。
(3)下列关于有机物B的说法正确的是_________(填字母代号)。
a.能发生取代反应 b.能与浓溴水反应
c.能发生消去反应 d.能与H2发生加成反应
(4)A→B的化学方程式为_________。
(5)C的分子式为_________,符合下列条件的C的同分异构体有_________种。
①能发生银镜反应
②能与NaHCO3溶液反应
③分子中有苯环,分子中无![]() 结构
结构
在上述同分异构体中,有一种苯环上有两个取代基且核磁共振氢谱图有4种峰的物质,写出该物质与足量NaOH溶液共热反应的化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A | B | C | D |
|
|
|
|
t1时仅加入催化剂,平衡向正方向移动 | 达平衡时,仅改变x,则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数减小 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L1·s1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com