
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P100kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
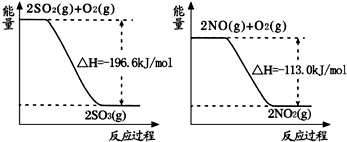
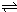 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1,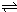 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,| ①-② |
| 2 |
| -196.6kJ/mol-(-113.0kJ/mol) |
| 2 |
| 5 |
| 7 |
| 1 |
| 1+a |
| Kw |
| c(H+) |
| 10-14 |
| 10-5 |
c(N
| ||
| c(NH3?H2O) |
| 0.1mol/L×10-9mol/L |
| 10-5mol/L |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、向某未知溶液中滴加足量稀盐酸,再加几滴BaCl2溶液,检验SO42-的存在 |
| B、用100mL量筒量取20.00mL Na2CO3溶液 |
| C、不用另加任何试剂就能鉴别HCl、Na2CO3、Na2SO4 和BaCl2四种无色溶液 |
| D、用粥汤检验淀粉溶液具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②>④>③>① |
| B、②>④>①>③ |
| C、③>①>②>④ |
| D、①>④>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解NaNO3溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| B、电解CuSO4溶液一段时间后,再加入一定质量Cu(OH)2,溶液能与原溶液完全一样 |
| C、电解硫酸钠溶液时,Na+向阳极移动 |
| D、电解KOH溶液,实质上是电解水,故溶液pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A2+2B2=2AB2 |
| B、2A2+B2=2A2B |
| C、3A2+B2=2A3B |
| D、A2+3B2=2AB3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
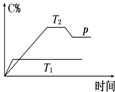 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )| A、4、4、5 |
| B、2、5、4 |
| C、4、3、6 |
| D、4、6、4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com