
| 温度/℃ | 15 | 20 | 25 | 30 | 35 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
分析 (1)①K为生成物浓度幂之积与反应物浓度幂之积的比,纯固体不能列入表达式中;
②结合平衡的特征“等、定”及衍生的物理量判断;
③若在恒温下增大容器体积,压强减小,平衡正向移动;
④由表格中数据可知,升高温度,平衡总压强增大,则平衡正向移动,且气体的混乱度增大;
(2)由①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H2=+172.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.0kJ•mol-1
结合盖斯定律可知,①-②-③得到2CO(g)+SO2(g)=S(s)+2CO2(g).
解答 解:(1)①由NH2COONH4(s)?2NH3(g)+CO2(g)可知,K=c2(NH3)c(CO2),故答案为:K=c2(NH3)c(CO2);
②A.没有标明正逆反应速率,无法判断平衡状态,故A错误;
B.由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故B正确;
C.生成物中氨气与二氧化碳的体积比为2:1,则密闭容器中CO2的体积分数不变,不能说明正逆反应速率相等、各组分浓度不变,故C错误;
D.由于反应前后气体的化学计量数之和不相等,压强不变,达到了平衡状态,故D正确;
故答案为:BD;
③若在恒温下增大容器体积,压强减小,平衡正向移动,则氨基甲酸铵固体的质量将减少,故答案为:减少;
④由表格中数据可知,升高温度,平衡总压强增大,则平衡正向移动,且气体的混乱度增大,则该反应的焓变△H>0,熵变△S>0,
故答案为:>;>;
(2)由①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H2=+172.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.0kJ•mol-1
结合盖斯定律可知,①-②-③得到2CO(g)+SO2(g)=S(s)+2CO2(g),△H=(-393.5kJ•mol-1)-(+172.5kJ•mol-1)-(-296.0kJ•mol-1)=-270.0kJ•mol-1,
即热化学方程式为2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270.0kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270.0kJ•mol-1.
点评 本题考查化学平衡的计算及焓变计算,为高频考点,把握K的表达式、平衡特征及判定、平衡移动、盖斯定律等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
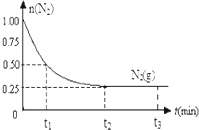 一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.
一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则可知C的燃烧热为11.5KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(I-)=0.1mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Cl-、Na+、NO3-、Fe2+ | |
| D. | 由水电离出的c(OH-)=1×10-10mol.L-1的溶液中:Ba2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 | |
| B. | 浓硫酸和浓硝酸都不能用来直接跟锌粒反应制氢气 | |
| C. | 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 | |
| D. | 浓硫酸和浓硝酸都能与单质碳反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子 | |
| C. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com