
����Ŀ�����ԭ����ԭ���ԭ���ǵ绯ѧ��������Ҫ���ݣ�ij��ȤС��������̽��ʵ�飺

��1����ͼ 1 Ϊijʵ��С������������ԭ��Ӧ��Ƶ�ԭ���װ�ã��÷�Ӧ�����ӷ���ʽΪ ________________��
��2����ͼ 2�������������䣬�����Ż���������ͭ������ʯī������ n �κ����������ָ��Ҳ��ƫת������װ����ʯī(1)Ϊ __________________________���� ��װ����ʯī(2)�缫�Ϸ����ķ�ӦʽΪ ___________________________��
��3����ͼ2��װ���и�Ϊ���� 400 mL CuSO4 ��Һ��һ��ʱ������缫��������1.28g�����ʱ��Һ��pH Ϊ ____________________________��
��4���� H2��O2�������� Na2CO3 ���ȼ�ϵ�أ����õ�ⷨ�Ʊ� Fe��OH��2��װ����ͼ3��ʾ��
��ʯī��缫�ϵĵ缫��ӦʽΪ __________________________��
��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ��������˵������ȷ����_��
a��X��Y ���˶������������缫
b�������� NaOH ��Һ��Ϊ���Һ
c�����������ķ�Ӧ�ǣ�2H2O+2e���TH2��+2OH��
d��Y ���ǵ��ص�����
���𰸡�Fe+Cu2+=Fe2++Cu �� 2Cl-��2e-= Cl2�� 1 O2+2CO2+4e-= 2CO32- B��C
��������
��1��ͼ1Ϊ˫Һԭ��أ�����FeΪ������Fe-2e-= Fe2+��ʯīΪ�������������Һ�е�Cu2+�õ���������Cu������ʯī���棬�缫��ӦΪCu2++2e-=Cu��
��2�������Ż���������ͭ������ʯī������ n �κײ�Ϊԭ��أ��Ҳ�Ϊ���أ�ԭ����У�����������ʧ���ӣ��缫��ӦΪ��Fe-2e-= Fe2+��ͭ�������� O2+2H2O+4e-= 4OH-�������У�ʯī2Ϊ������2Cl--2e-=Cl2����ʯī1Ϊ������Cu2++2e-=Cu��
��3��ͼ2����װ��Ϊ���أ��缫��ӦΪ��Cu2++2e-=Cu�����缫��������1.28g��0.02molʱ��ת�Ƶ���0.04mol������ܷ�Ӧ2CuSO4+2H2O![]() 2Cu+2H2SO4+O2���м��㣻
2Cu+2H2SO4+O2���м��㣻
��4���ٸ���װ�ÿ�֪��ʯī�缫Iͨ��H2����������Ӧ����������
��ʯī�缫Iͨ��H2����������Ӧ����������ʯī�缫IIͨ��������������ԭ��ӦΪ���������ʱ��XΪ������YΪ��������������ʧ��������Fe2+��X�缫H+�õ�������H2��OH-Ũ��������Fe2+������������������������ݴ˷������
��1����װ��Ϊ˫Һԭ��أ�����FeΪ������Fe-2e-= Fe2+��ʯīΪ�������������Һ�е�Cu2+�õ���������Cu������ʯī���棬�缫��ӦΪCu2++2e-=Cu����������ԭ��ӦΪ��Fe+Cu2+=Fe2++Cu��
��2�������Ż���������ͭ������ʯī������ n �κײ�Ϊԭ��أ��Ҳ�Ϊ���أ�ԭ����У�����������ͭ�������������У�ʯī2���Դ����������Ϊ������2Cl--2e-=Cl2����ʯī1���Դ����������Ϊ������
��3���缫��������1.28g��0.02molʱ��ת�Ƶ���0.04mol������H+0.04mol��c(H+)=![]() =0.1mol/L��pH=1��
=0.1mol/L��pH=1��
��4����4���ٸ���װ�ÿ�֪��ʯī�缫Iͨ��H2����������Ӧ������������ⷴӦΪ��O2+2CO2+4e-= 2CO32-��
�� A.X��Y���ˣ�����Y�����缫��X��һ���������缫��ʯī���缫Ҳ���ԣ�A�����
B.��������������H+�ŵ�õ���Һ�е�OH-����Fe2+���������������������˿�����NaOH ��Һ��Ϊ���Һ��B����ȷ��
C.������������ͬҵ�е�H+�õ�������H2�ķ�Ӧ���缫��ӦΪ��2H2O+2e���TH2��+2OH����C����ȷ��
D. ���ʱ��XΪ������YΪ������D�����
��ѡBC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�����ӽ���Ĥ����ⱥ��ʳ��ˮԭ��ʾ��ͼ������˵����ȷ����
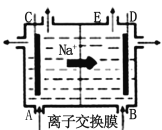
A.��E���ݳ��������� Cl2
B.ÿ���� 22.4 L Cl2��ͬʱ����2 mol NaOH
C.��B�ڼ��뺬����NaOH��ˮ��Һ����ǿ������
D.������Na2CO3��NaOH��BaCl2��������Լ���ȥ����ˮ��Ca2+��Mg2+��Fe3+��SO42��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A.ͭͶ��Ũ�����У�Cu + 2NO![]() + 2H+ = Cu2+ + 2NO��+ H2O
+ 2H+ = Cu2+ + 2NO��+ H2O
B.������Ͷ��ϡ�����У�Al2O3 + 6H+ =2Al3+ + 3H2O
C.�ƺ�ˮ��Ӧ��Na + H2O = Na+ + OH�� + H2��
D.��ʳ���ܽ�������þ��Mg(OH)2��2H+=Mg2++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�������ͼʵ��װ�ü���Ӧ������ȡ���ʵ��ʱ�����ƿ�з�Ӧ�Ļ�ѧ����ʽΪ��NH3+CO2+H2O+NaCl= NaHCO3��+NH4Cl�����з�����ȷ����

A. ��������Ӧ��ͨ�백��
B. �����ܼ�Ӧ������ͨ������
C. �������Ӧʢװ��ʯ��
D. ���ƿ���������ˮԡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ش�

��1����Ӧ����__________��.
��2��2min��A��ƽ��������________��
��3��д����ѧ����ʽ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ����ʽ��д��ȷ��Ϊ�ӳɷ�Ӧ���ǣ� ��
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2+Br2��CH3-CHBr2
C.CH2=CH2��H2O![]() CH3CH2OH
CH3CH2OH
D.![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ��Ca(ClO)2��Һ��ͨ������CO2��2ClO+CO2+H2O2HClO+![]()
B. ��AgCl����Һ�м���Na2S��Һ����ɫ������ɺ�ɫ��2AgCl+S2Ag2S+2Cl
C. ��ǿ����Һ���չ�ҵβ����ȡ������NO+NO2+2OH2![]() +H2O
+H2O
D. ��Ī����[(NH4)2Fe(SO4)2��6H2O����Һ�м����������������Һ��![]() +Fe2++3OHNH3��H2O+Fe(OH)2��
+Fe2++3OHNH3��H2O+Fe(OH)2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ������������������ͻ���۶���ȷ����![]()
ѡ�� | ʵ����� | �������� | ���ͻ���� |
A | ��NaCl��KI�Ļ����Һ�У���μ��� | ��Һ���Ȳ�����ɫ�������������ɫ���� |
|
B | �ò�����պȡ��ˮ�㵽��ɫʯ����ֽ�� | ��ֽ�ȱ�����ɫ | ��ˮ�к��� |
C | ��ͭƬ��оƬ�õ������Ӻ���ϡ������ | ͭƬ�������ݲ��� | ��п�������£�ͭ�����ᷴӦ�������� |
D | ��ij��Һ�м���������� | ������ʹ����ʯ��ˮ����ǵ���ɫ���� | ����ҺΪ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ(������������������ȥ�����з�Ӧ�ڵ������ǡ�700 �棬������)��G�dz����ĺ�ɫ�������ʣ�B��H�ǿ�������Ҫ�ɷ֣�A��C��E���dz������壬D���������ɫҺ�塣
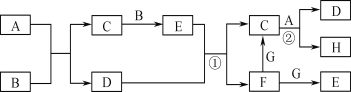
��ش��������⣺
��1��E�Ļ�ѧʽΪ________________��
��2��A�ĵ���ʽΪ________________��
��3��д����Ӧ�ٵ����ӷ���ʽ��________________________________��
��4��д����Ӧ�ڵĻ�ѧ����ʽ�����������ת�Ƶķ�������Ŀ��
______________ __________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com