
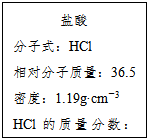
 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:分析 (1)根据c=$\frac{1000ρω}{M}$计算该浓盐酸中HCl的物质的量浓度;
(2)根据方程式计算1molKMnO4完全反应生成KCl、MnCl2的物质的量,利用氯原子守恒可知,生成物中n(Cl-)=n(KCl)+2n(MnCl2),再根据c=$\frac{n}{V}$计算Cl-的物质的量浓度;
(3)根据方程式计算生成氯气的物质的量,再根据V=nVm计算氯气的体积.
解答 解:(1)质量分数36.5%,密度为1.19g/mL的盐酸的物质的量浓度=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,
故答案为:11.9;
(2)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2 2 2
1mol 1mol 1mol
所得产物中Cl-的物质的量n(Cl-)=n(KCl)+2n(MnCl2)=1mol+2mol=3mol,则所得产物中Cl-的物质的量浓度为$\frac{3mol}{2L}$=1.5mol/L,
故答案为:1.5mol/L;
(3)8mol HCl完全反应,令生成的氯气的物质的量为x,则:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
16 5
8mol x
故x=$\frac{8mol×5}{16}$=2.5mol,故氯气的体积为2.5mol×22.4L/mol=56L,
故答案为:56L.
点评 本题考查根据方程式的计算、物质的量浓度计算等,比较基础,注意物质的量浓度与质量分数的关系,侧重于考查学生的计算能力和分析能力.


科目:高中化学 来源: 题型:解答题
| 装 置 | 现 象 |
 | Ⅰ.实验初始,未见明显现象 |
| Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 | |
| Ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装置 | 现象 |
 | Ⅰ.实验初始,未见明显现象 |
| Ⅱ.过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2的摩尔质量为95g | |
| B. | 常温常压下,1molCO2的质量是44g | |
| C. | 标准状况下,1molH2O所占体积约为22.4L | |
| D. | 100mL 1mol/L的稀硫酸中含有H+的数目约为6.02×10 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
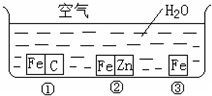 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应停止了 | B. | 正、逆反应的速率都为0 | ||
| C. | 正、逆反应都还在进行 | D. | 正、逆反应的速率相等且不为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
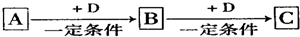
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,则H2燃烧热(△H)为-241.8kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)=2CO(g)的△H=+172.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它们一定是同系物 | |
| B. | 它们一定是同分异构体 | |
| C. | 含C,H,O百分数一定相同 | |
| D. | 等质量的A,B燃烧时耗氧量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
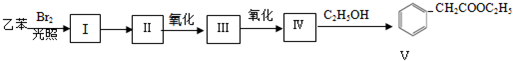
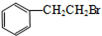 .
. .
.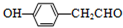 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com