
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
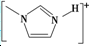 ]BF${\;}_{4}^{-}$的熔点(填>、=或<),其原因是两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
]BF${\;}_{4}^{-}$的熔点(填>、=或<),其原因是两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低. 分析 (1)根据第一至第四电离能的变化可判断出各元素的最高化合价,进而推断元素的种类;
(2)A.Ge是一种金属元素,但最外层电子数为4,金属性不强;
B.硫的其电负性大于硅,硅的电负性大于锗;
C.锗单质是一种半导体材料;
D.组成和结构相似的分子晶体,相对分子质量越小,熔点越低;
(3)A.根据氢键形成的条件;
B.同种元素原子形成的共价键是非极性键;不同种元素原子形成的共价键是极性键;
C.1个单键是1个σ键,一个双键是1个σ键和1个π键;
D.根据醇羟基比甲基更溶于水;
(4)离子化合物,且电荷数相等,离子半径大,离子键较弱,因此熔点较低.
解答 解:(1)从表中原子的第一至第四电离能可以看出,元素的第一、第二、第三电离能都较小,可失去3个电子,最高化合价为+3价,即最外层应有3个电子,应为铝元素,
故答案为:Al;
(2)A.Ge是一种金属元素,但最外层电子数为4,金属性不强,故A错误;
B.硫的其电负性大于硅,硅的电负性大于锗,所以锗的电负性小于硫,故B错误;
C.锗单质是一种半导体材料,故C正确;
D.氯化锗和溴化锗都是分子晶体,但氯化锗的相对分子质量小于溴化锗,所以氯化锗沸点低于溴化锗的沸点,
故选:CD;
(3)A.HOH2CCH2OH分子间羟基和羟基之间可以形成氢键,故A正确;
B.分子中碳碳键是非极性键,碳氢键、碳氧键是极性键,故B正确;
C.1个单键是1个σ键,一个双键是1个σ键和1个π键,所以分子中有9个σ键没有π键,故C错误;
D.根据醇羟基比甲基更溶于水,所以HOH2CCH2OH分子溶解度大于2-丁烯,故D正确;
故选:ABD;
(4)两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低,
故答案为:>;两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
点评 本题考查了物质结构和性质,涉及电离能、原子的电子排布式、有机物的结构与性质、配位键等知识点,这些知识点都是考试高频点,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | SO2通入溴水中,溶液褪色 | 检验SO2的漂白性 |
| B | 向2mL淀粉溶液中加入稀硫酸,加热2min,加入新制Cu(OH)2在加热,无明显现象. | 淀粉在酸性条件下不水解 |
| C | 将制得的阿司匹林粗产品与饱和碳酸氢钠溶液充分反应后过滤 | 除去阿司匹林中的聚合物 |
| D | 等体积、pH同为3的酸A和B分别与足量的Zn反应,酸A放出的氢气多 | 酸性A比B强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制浓硫酸、浓硝酸的混酸时,应将浓硝酸沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用滴定管、量筒量取5.0mL液体,俯视读数时所得液体体积均大于5mL | |
| C. | 大试管、烧瓶、锥形瓶均可用于组装气体发生装置 | |
| D. | 实验室配制一定质量分数、一定物质的量浓度的溶液时均需使用容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2;大理石和稀硫酸,澄清石灰水 | |
| B. | Cl2;二氧化锰和浓盐酸,湿润的淀粉碘化钾试纸 | |
| C. | O2;二氧化锰和双氧水,带火星的木条 | |
| D. | NH3;氯化铵固体和氢氧化钙固体,湿润的红色石蕊试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 ;
; .分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式
.分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式 或
或
 ,如果要合成
,如果要合成  所用的原始原料可以是AC.
所用的原始原料可以是AC.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com