
已知一定温度下,X(g)+2Y(g)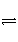
 mZ(g) ΔH=-a kJ·mol-1(a>0)。现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1 mol X和2 mol Y,达平衡状态时,放出热量b kJ;向密闭容器乙中通入2 mol X和4 mol Y,达平衡状态时,放出热量c kJ,且2b<c,则下列各值关系正确的是( )
mZ(g) ΔH=-a kJ·mol-1(a>0)。现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1 mol X和2 mol Y,达平衡状态时,放出热量b kJ;向密闭容器乙中通入2 mol X和4 mol Y,达平衡状态时,放出热量c kJ,且2b<c,则下列各值关系正确的是( )
A.a=b B.2a<c C.m>3 D.m<3
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
用石墨做电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来的状态( )
A.CuSO4 B.CuO C.Cu(OH)2 D.CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有N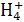 、S
、S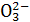 、Si
、Si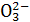 、Br-、C
、Br-、C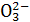 、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有N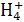 、Na+ ②有胶状物质生成 ③有气体产生 ④溶液颜色发生变化 ⑤共发生了2个氧化还原反应
、Na+ ②有胶状物质生成 ③有气体产生 ④溶液颜色发生变化 ⑤共发生了2个氧化还原反应
A.①②③④ B.②③④
C.①③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,把1 mol N2和3 mol H2通入一个固定容积的密闭容器里,发生如下反应:
N2(g)+3H2(g)
 2NH3(g)
2NH3(g)
当此反应进行到一定程度时,反应中的混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始时加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=________。
(2)若a=0.5,则b=________、c=________。
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c):____________________________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)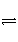
 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是( )
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是( )
A.2 mol C
B.2 mol A和1 mol B
C.1 mol B和1 mol C
D.2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.12g金刚石晶体中含有的C—C的数目为2NA
B.1L 1 mol·L-1 AlCl3溶液中含有的Al3+数目为NA
C.在标况下,11.2L氯气通入足量的NaOH溶液中转移电子数为NA
D.常温常压下,22g CO2气体中含有的σ键和π键的数目均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
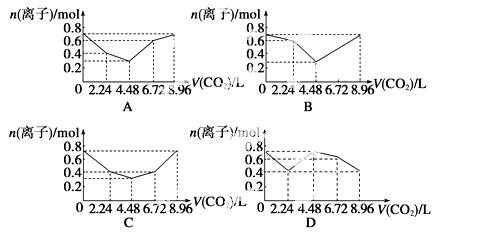
向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(0 ℃,1.01×105 Pa)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计) ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.6 g 纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min 末收集到氢气1.12 L(标况),在此之后,又经过4 min 铁粉全部溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是多少?
(2)在后4 min内用HCl表示的平均反应速率是多少?
(3)前2 min与后4 min相比,反应速率哪个较快?为什么?试解释原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com