
 .
.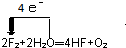 .
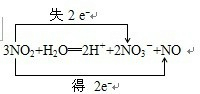
.分析 (1)含元素化合价变化的反应为氧化还原反应,水被氧化,则水中O元素的化合价升高,水被还原,则水中H元素的化合价降低;若水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原;
(2)根据反应寻找失电子和得电子的元素的原子,化合价升高或降低的数目就是转移的电子数;
(3)根据反应寻找失电子和得电子的元素的原子,单线桥即标出失电子的元素指向得电子的元素,化合价升高或降低的数目就是转移的电子数,据此书写;
(4)2Na+2H2O═2NaOH+H2↑的离子方程式为2Na+2H2O═2Na++2OH-+H2↑.
解答 解:(1)只有①⑤⑥反应中没有元素的化合价变化,不属于氧化还原反应;只有③水中O元素的化合价升高,水被氧化;只有④水中H元素的化合价降低,水被还原;只有②中属于氧化还原反应,但水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,
故答案为:①⑤⑥;③;④;②;
(2)该反应中,只有氮原子化合价变化,电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(3)2F2+2H2O═4HF+O2反应中O失电子,F得电子,所以用单线桥表示电子转移的方向和数目为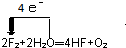 ,故答案为:
,故答案为: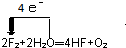 ;
;
(4)2Na+2H2O═2NaOH+H2↑的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故答案为:2Na+2H2O═2Na++2OH-+H2↑.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15.6% | B. | 25% | C. | 30% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Li>Cs>Na | B. | 微粒半径:Ca2+>C1->Mg2+ | ||
| C. | 碱性:KOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:Cu2+>Fe3+>K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com