
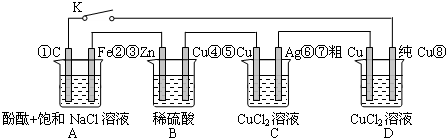
| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B、C、D装置中pH均变大. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
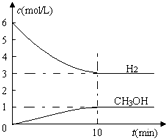 T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如下图所示.下列说法不正确的是( )
T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如下图所示.下列说法不正确的是( )| A、0~10 min 内υ(H2)=0.3 mol/(L?min) | ||
B、T℃时,平衡常数K=
| ||
| C、T℃时,若上述反应中有64 g CH3OH生成,则同时放出98.0 kJ的热量 | ||
| D、达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
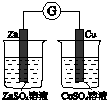 |  | 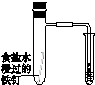 | 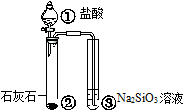 |
| 验证化学能 转化为电能 | 证明温度 对平衡移动的影响 | 验证铁 发生析氢腐蚀 | 验证H2CO3的酸性大于H2SiO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
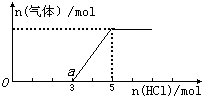 将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).下列说法不正确的是( )
将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).下列说法不正确的是( )| A、O点溶液中所含溶质的化学式为NaOH、Na2CO3 |
| B、O到a点发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3- |
| C、通入CO2气体的体积在标准状况下为44.8L |
| D、NaOH溶液的物质的量浓度为5mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、改变温度可以改变此反应的平衡常数 |
| C、反应可表示为X+3Y?2Z,平衡常数为1600 |
| D、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥⑦ | B、②③⑤⑧ |
| C、①②⑧ | D、①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com