

 .D为Cl2,Cl元素原子结构示意图为
.D为Cl2,Cl元素原子结构示意图为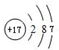 ,
, ;
; ;
;
| ||
| ||


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、5.1g | B、10.2g |
| C、13.6g | D、15.3g |
查看答案和解析>>
科目:高中化学 来源: 题型:
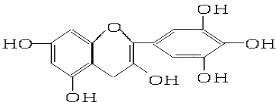 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )| A、①② | B、①④ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.015mol?L-1 |
| B、0.011mol?L-1 |
| C、0.00751mol?L-1 |
| D、0.00251mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:
实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:
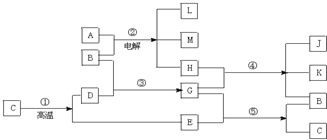
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铅笔芯的主要成分是金属铅,儿童在使用是不可用嘴吮吸,以免引起铅中毒 |
| B、CO有毒,在生有炉火的居室中多放几盆水,可吸收CO,防止煤气中毒 |
| C、含氟冰箱产生的氟利昂是造成臭氧空洞的主要原因 |
| D、油条制作中常加入明矾作膨化剂,有利于补充身体所需微量元素,是理想早餐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该合金中铜与镁的物质的量之比是2:1 |
| B、得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| C、NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D、该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com