
| A. | 钠在氯气中燃烧 | B. | 二氧化碳通入澄清的石灰水中 | ||
| C. | 氯化钠溶液中滴加硝酸银溶液 | D. | 锌粒放入稀硫酸中 |
分析 离子反应,应能在溶液中进行,且有离子参加反应,氧化还原反应的特征是有化合价的升降,以此解答该题.
解答 解:A.钠在氯气中燃烧生成氯化钠,属于氧化还原反应,但不是离子反应,故A错误;
B.二氧化碳通入澄清的石灰水,该反应的实质是CO2+Ca2++2OH-=CaCO3↓+H2O,该反应中各元素的化合价都不变,所以不是氧化还原反应,但是离子反应,故B错误;
C.氯化钠溶液中滴加硝酸银溶液生成氯化银沉淀和硝酸钠,属于离子反应,但元素的化合价没有发生变化,不是氧化还原反应,故C错误;
D.锌粒放入稀硫酸中,反应的实质是Zn+2H+=H2+Zn2+,既是离子反应又是氧化还原反应,故D正确;
故选D.
点评 本题考查氧化还原反应,题目难度不大,注意把握离子反应以及氧化还原反应的实质.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
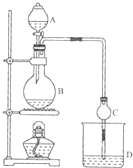 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | $\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ba2+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入硫酸钙做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 观看电影时,从放映机到银幕有明显的光路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com